解题方法
1 . i.研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式_______ 。
ii.环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。请回答下列问题:
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因:_______ 。
(2)汽车排气管内安装催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔΗ=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔΗ=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g) ΔΗ=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔΗ=_______ kJ·mol-1。
iii.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为 。请回答下列问题:
。请回答下列问题:
(1)该燃料电池的正极反应式为_______ 。
(2)该燃料电池的负极反应式为_______ 。
(3)当外电路中通过1.2mol电子时,理论上消耗甲醇的质量是_______ g。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式
ii.环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。请回答下列问题:
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因:
(2)汽车排气管内安装催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔΗ=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔΗ=-221.0kJ·mol-1
C(s)+O2(g)=CO2(g) ΔΗ=-393.5kJ·mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔΗ=
iii.据报道,最近摩托罗拉公司研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为
 。请回答下列问题:
。请回答下列问题:(1)该燃料电池的正极反应式为
(2)该燃料电池的负极反应式为
(3)当外电路中通过1.2mol电子时,理论上消耗甲醇的质量是
您最近一年使用:0次
2 . 面对气候变化,我国承诺二氧化碳排放力争2030年前达到峰值,力争2060年前实现碳中和。“碳达峰、碳中和”目标下,必须加强对二氧化碳资源化利用的研究。
(1) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。
。
已知:
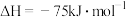
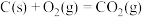
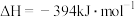
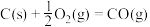
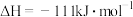
该催化重整反应的
___________  ,反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
,反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
由上表判断,催化剂X___________ Y(填“优于”或“劣于”),理由是___________ 。
(2) 经催化加氢可合成低碳烃:
经催化加氢可合成低碳烃: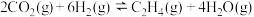 。在
。在 恒容密闭容器内,按
恒容密闭容器内,按 投料,测得各组分物质的量随时间变化如图所示。曲线
投料,测得各组分物质的量随时间变化如图所示。曲线 表示的物质为
表示的物质为___________ (填化学式),该物质在 内的平均反应速率为
内的平均反应速率为___________ (结果保留2位小数)。
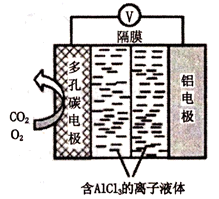
(3) 辅助的
辅助的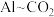 电池工作原理如图所示。该电池电容量大,能有效利用
电池工作原理如图所示。该电池电容量大,能有效利用 ,电池反应产物
,电池反应产物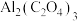 是重要的化工原料。电池的负极反应式:
是重要的化工原料。电池的负极反应式:___________ 。电池的正极反应式: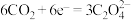 。该过程中,
。该过程中, 起催化作用,催化过程可表示为:i:
起催化作用,催化过程可表示为:i: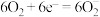 ii:……,写出ii的离子方程式:
ii:……,写出ii的离子方程式:___________ 。
(1)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。
。已知:

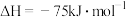
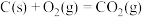
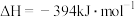
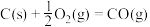
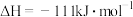
该催化重整反应的

 ,反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
,反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:积碳反应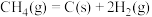 | 消碳反应 | ||
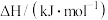 | +75 | +172 | |
活化能/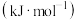 | 催化剂 | 33 | 91 |
催化剂 | 43 | 72 | |
由上表判断,催化剂X
(2)
 经催化加氢可合成低碳烃:
经催化加氢可合成低碳烃: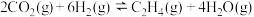 。在
。在 恒容密闭容器内,按
恒容密闭容器内,按 投料,测得各组分物质的量随时间变化如图所示。曲线
投料,测得各组分物质的量随时间变化如图所示。曲线 表示的物质为
表示的物质为 内的平均反应速率为
内的平均反应速率为
(3)
 辅助的
辅助的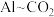 电池工作原理如图所示。该电池电容量大,能有效利用
电池工作原理如图所示。该电池电容量大,能有效利用 ,电池反应产物
,电池反应产物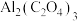 是重要的化工原料。电池的负极反应式:
是重要的化工原料。电池的负极反应式: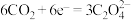 。该过程中,
。该过程中, 起催化作用,催化过程可表示为:i:
起催化作用,催化过程可表示为:i: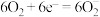 ii:……,写出ii的离子方程式:
ii:……,写出ii的离子方程式:
您最近一年使用:0次
名校
3 . 下列说法正确的是
| A.当反应体系放热时其焓减小,ΔH为负值 |
| B.化学键断裂的能量是化学变化中能量变化的主要原因 |
| C.一个化学反应,不管是一步完成的还是分几步完成的,其反应热是不相同的 |
| D.苛性钠固体溶于水属于放热反应 |
您最近一年使用:0次
2021-07-07更新
|
232次组卷
|
3卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题
解题方法
4 . 根据能量变化示意图,下列说法不正确的是

| A.2molCO(g)与1molO2(g)完全反应生成2molCO2(g)时要释放566kJ的能量 |
| B.1molCH4(g)与2molO2(g)具有的总能量高于1molCO2(g)与2molH2O(l) |
| C.1molCH4(g)完全燃烧生成气态水时释放的能量小于890kJ |
| D.16kg液化天然气完全燃烧释放的能量为890000kJ |
您最近一年使用:0次
解题方法
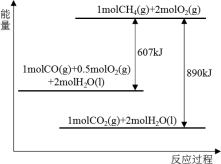
5 . 大气中SO2、H2S的资源化利用具有重要意义。回答下列问题:
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为___ 。
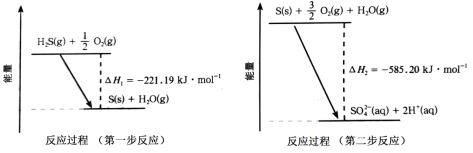
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
b电极为___ 极(填“正”或“负”),其电极反应式为___ 。
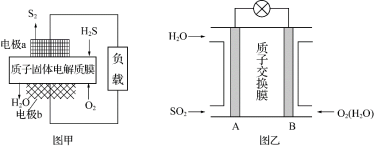
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为___ (填“从A到B”或“从B到A”)。
②负极的电极反应式为___ 。
③用该电池处理32gSO2,理论上需要消耗O2的体积为___ L(标准状况)。
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。

b电极为
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为
②负极的电极反应式为
③用该电池处理32gSO2,理论上需要消耗O2的体积为
您最近一年使用:0次
解题方法
6 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次
7 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
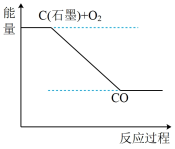 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次
名校
8 . 反应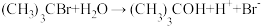
 分两步进行,反应如下:
分两步进行,反应如下:
第一步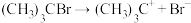 (慢反应)
(慢反应) 
第二步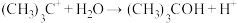 (快反应)
(快反应)
该反应的能量与反应历程图象正确的是
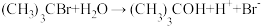
 分两步进行,反应如下:
分两步进行,反应如下:第一步
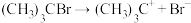 (慢反应)
(慢反应) 
第二步
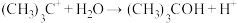 (快反应)
(快反应)该反应的能量与反应历程图象正确的是
A.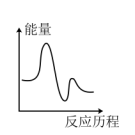 | B.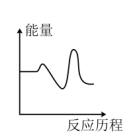 |
C.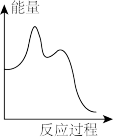 | D.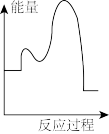 |
您最近一年使用:0次
2021-05-20更新
|
796次组卷
|
11卷引用:云南省保山市腾冲市第八中学2020-2021学年高一下学期期末考试化学试题
云南省保山市腾冲市第八中学2020-2021学年高一下学期期末考试化学试题湖南省永州市省重点中学2021届高三5月联考化学试题河北省沧州市2021届高考第二次模拟考试化学试题辽宁省朝阳市2021届高三第四次模拟考试化学试题山西省2020-2021学年高二下学期5月考试化学试题河南省南阳地区2020-2021学年高二下学期阶段检测考试化学试题湖南省重点中学2020-2021学年高二下学期5月份联合考试化学试题(已下线)1.3 化学反应热的计算-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第一章 化学反应与能量 单元综合检测-2021-2022学年高二化学课后培优练(人教版选修4)湖南省长沙市长郡梅溪湖中学2022-2023学年高二上学期第三次月考化学试题广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题
名校
9 . (1)在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9 kJ的热量。该反应的ΔH ___________ 0 (填“>”或“<”),对于石墨和金刚石,___________ 更稳定。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
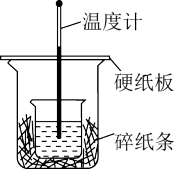
①从实验装置上看,图中尚缺少的一种玻璃用品是___________ 。
②大烧杯上如不盖硬纸板,测得的反应热数值___________ (填“偏大、偏小、无影响”)。
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式___________ 。
(4)已知几种化学键的键能如表所示:
则反应Cl2(g)+ 3F2(g) 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =___________ kJ/mol
(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:___________ 。
(2)用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是
②大烧杯上如不盖硬纸板,测得的反应热数值
③用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的反应热的数值会
(3)在25℃、101 kPa下,1g CH3OH(l)完全燃烧生成CO2和液态水时放热22.68 kJ。写出表示CH3OH燃烧热的热化学方程式
(4)已知几种化学键的键能如表所示:
| 化学键 | Cl—Cl | F—F | Cl—F |
| 键能/ (kJ/mol) | 242 | 159 | 172 |
则反应Cl2(g)+ 3F2(g)
 2ClF3(g) 的ΔH =
2ClF3(g) 的ΔH =(5)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)=4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) =2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 = -1251 kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
您最近一年使用:0次
解题方法
10 . 联氨( )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。
①已知断开(或形成)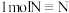 键、
键、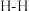 键分别需要吸收(或放出)
键分别需要吸收(或放出)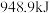 ,
, 的热量,合成
的热量,合成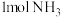 可放出
可放出 的热量,则形成
的热量,则形成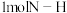 放出的热量为
放出的热量为___________  (保留一位小数)。
(保留一位小数)。
②工业上一种制备联氨的方法为 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是___________ (填写化学式)。制备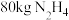 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________  。
。
(2)发射航天器时常以 为燃料,
为燃料, 为推进剂。
为推进剂。
已知
ⅰ.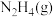 的摩尔燃烧焓为
的摩尔燃烧焓为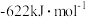 。
。
ⅱ.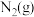 与
与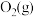 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下:
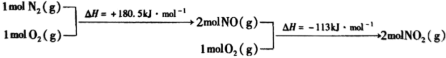
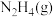 与
与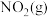 反应生成
反应生成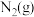 和
和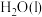 的热化学方程式为
的热化学方程式为___________ 。
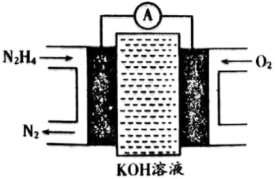
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中 的物质的量浓度
的物质的量浓度___________ (填“增大”“减小”或“不变”),负极反应式为___________ 。
 )是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:(1)工业上利用
 和
和 合成
合成 ,用
,用 进一步制备联氨
进一步制备联氨 。
。①已知断开(或形成)
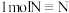 键、
键、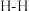 键分别需要吸收(或放出)
键分别需要吸收(或放出)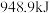 ,
, 的热量,合成
的热量,合成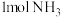 可放出
可放出 的热量,则形成
的热量,则形成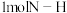 放出的热量为
放出的热量为 (保留一位小数)。
(保留一位小数)。②工业上一种制备联氨的方法为
 。该反应涉及物质中属于离子化合物的是
。该反应涉及物质中属于离子化合物的是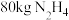 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为 。
。(2)发射航天器时常以
 为燃料,
为燃料, 为推进剂。
为推进剂。已知
ⅰ.
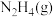 的摩尔燃烧焓为
的摩尔燃烧焓为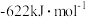 。
。ⅱ.
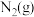 与
与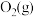 反应的物质和能量变化示意图如下:
反应的物质和能量变化示意图如下: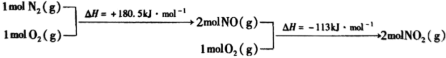
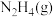 与
与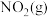 反应生成
反应生成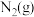 和
和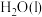 的热化学方程式为
的热化学方程式为(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次



