名校
1 . 用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol
(1)已知:①3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol
则a=___________ 。
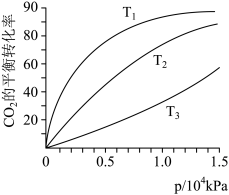
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系___________ ,实际生产条件控制在T1、1.3×104kPa左右,选择此压强的理由是___________ 。
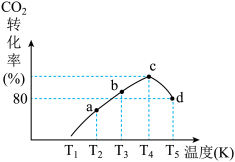
(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正___________ v逆(填“>”“<”或“=”);温度高于T4,CO2的转化率降低的原因是___________ 。已知容器内的起始压强为200kPa,则图中d点对应温度下反应的平衡常数Kp=___________ (kPa)-2(结果保留两位有效数字)(KP为以分压表示的平衡常数,分压=总压×物质的量分数)
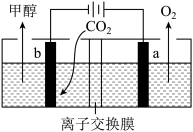
(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为___________ ;
②该装置中使用的是___________ (填“阳”或“阴”)离子交换膜。
 CH3OH(g)+H2O(g);ΔH=-akJ/mol
CH3OH(g)+H2O(g);ΔH=-akJ/mol(1)已知:①3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-247kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41kJ/mol
CO2(g)+H2(g) ΔH=-41kJ/mol则a=
(2)CO2在不同温度下的平衡转化率与压强的关系如下图所示。请写出T1、T2、T3三者的大小关系

(3)一定条件下,在相同体积的恒容密闭容器中充入1.0molCO2和3.0molH2,相同时间段内测得CO2的转化率随温度变化如图所示:b点v正

(4)用惰性电极电解强酸性的二氧化碳水溶液可得到甲醇,其原理如下图所示。
①b电极上的电极反应式为
②该装置中使用的是

您最近一年使用:0次
2 . (1)已知2molH2完全燃烧生成液态水时放出572kJ热量,则2molH2完全燃烧生成水蒸气时放出热量_______ (填大于、等于或小于)572kJ。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):
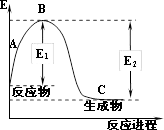
根据以上键能数据计算N—H键的键能为_______ kJ/mol。
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。
已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需___ (填“吸收”或“放出”)___ kJ能量。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):

| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 436 | 946 |
根据以上键能数据计算N—H键的键能为
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。

已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
Ⅰ.已知: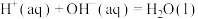
 ,现用下图所示装置测定中和热。
,现用下图所示装置测定中和热。
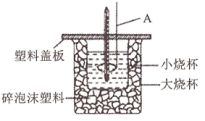
回答下列问题:
(1)碎泡沫塑料的作用是___________ ;若将A换为“铜丝搅拌棒”测得的 将
将___________ (填“偏大”、“偏小”或“不变”)。
(2)若用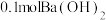 配制成稀溶液,与足量的稀硝酸反应,放出的热量为
配制成稀溶液,与足量的稀硝酸反应,放出的热量为___________ kJ。
Ⅱ.2021年5月29日天舟二号货运飞船成功发射,为中国空间站进一步开展在轨建造奠定了坚实基础,该飞船由长征七号遥三运载火箭搭载。长征七号遥三运载火箭使用煤油为燃料
(3)煤油的主要成分为 ,已知
,已知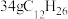 完全燃烧生成气态水时放出1386.2kJ热量;
完全燃烧生成气态水时放出1386.2kJ热量;
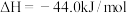 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为___________ 。
(4)前期的火箭曾用液态肼(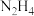 )与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为
)与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为___________ 。
Ⅲ.将氧化铁还原为铁的技术在人类文明进步中占据十分重要的地位。高炉炼铁中发生的部分反应为:
①
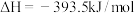
②

(5)已知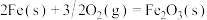
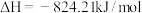 。则高炉内
。则高炉内 被CO还原为Fe的热化学方程式为
被CO还原为Fe的热化学方程式为___________ 。
(6)碳(s)在氧气不足的情况下燃烧,会生成CO,但同时也有部分生成 ,因此无法通过实验直接测得反应:
,因此无法通过实验直接测得反应: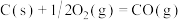 的
的 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有___________ 。若根据上述信息可计算出该反应的
___________ kJ/mol。
Ⅰ.已知:
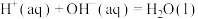
 ,现用下图所示装置测定中和热。
,现用下图所示装置测定中和热。
回答下列问题:
(1)碎泡沫塑料的作用是
 将
将(2)若用
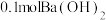 配制成稀溶液,与足量的稀硝酸反应,放出的热量为
配制成稀溶液,与足量的稀硝酸反应,放出的热量为Ⅱ.2021年5月29日天舟二号货运飞船成功发射,为中国空间站进一步开展在轨建造奠定了坚实基础,该飞船由长征七号遥三运载火箭搭载。长征七号遥三运载火箭使用煤油为燃料
(3)煤油的主要成分为
 ,已知
,已知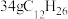 完全燃烧生成气态水时放出1386.2kJ热量;
完全燃烧生成气态水时放出1386.2kJ热量;
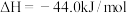 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为(4)前期的火箭曾用液态肼(
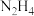 )与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为
)与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为Ⅲ.将氧化铁还原为铁的技术在人类文明进步中占据十分重要的地位。高炉炼铁中发生的部分反应为:
①

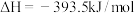
②


(5)已知
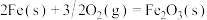
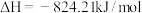 。则高炉内
。则高炉内 被CO还原为Fe的热化学方程式为
被CO还原为Fe的热化学方程式为(6)碳(s)在氧气不足的情况下燃烧,会生成CO,但同时也有部分生成
 ,因此无法通过实验直接测得反应:
,因此无法通过实验直接测得反应: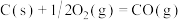 的
的 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有
您最近一年使用:0次
2021-07-22更新
|
255次组卷
|
2卷引用:四川省成都市龙泉驿区2020-2021学年高一下学期末学业质量监测联考化学试题
解题方法
4 . 石油是宝贵的能源,属于战略资源。 、
、 均是石油裂解的产物。请回答下列问题:
均是石油裂解的产物。请回答下列问题:
(1)石油裂化、裂解为_______ (填“物理”或“化学")变化。
(2)已知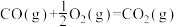
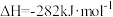
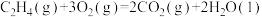
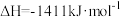
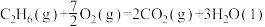
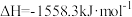
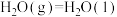
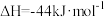
则反应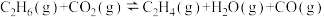

_______  。
。
(3)一定温度下,在某2L恒容密闭容器中充入1mol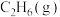 和1mol
和1mol 发生反应
发生反应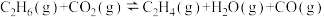 ,10min后达到平衡,容器内压强为起始压强的1.25倍。
,10min后达到平衡,容器内压强为起始压强的1.25倍。
①下列说法可以判定反应到达平衡状态的是_______ 。(填字母序号)
A.
B.相同时间内,断裂2mol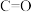 的同时断裂1mol
的同时断裂1mol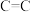
C.容器内气体的密度不再发生变化
D.容器内气体的平均相对分子质量不再发生变化
②0~10min,v(CO)=_______  ,
, 的转化率为
的转化率为_______ %, 的体积分数为
的体积分数为_______ %。
 、
、 均是石油裂解的产物。请回答下列问题:
均是石油裂解的产物。请回答下列问题:(1)石油裂化、裂解为
(2)已知
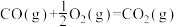
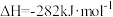
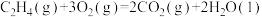
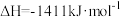
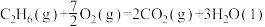
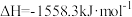
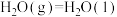
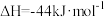
则反应
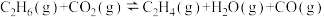

 。
。(3)一定温度下,在某2L恒容密闭容器中充入1mol
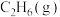 和1mol
和1mol 发生反应
发生反应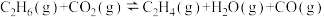 ,10min后达到平衡,容器内压强为起始压强的1.25倍。
,10min后达到平衡,容器内压强为起始压强的1.25倍。①下列说法可以判定反应到达平衡状态的是
A.

B.相同时间内,断裂2mol
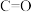 的同时断裂1mol
的同时断裂1mol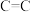
C.容器内气体的密度不再发生变化
D.容器内气体的平均相对分子质量不再发生变化
②0~10min,v(CO)=
 ,
, 的转化率为
的转化率为 的体积分数为
的体积分数为
您最近一年使用:0次
名校
5 . 按要求书写下列方程式:
(1)制备粗硅的化学方程式___________ 。
(2)碱性锌锰干电池的正极反应式___________ 。
(3)用氢氧化钠溶液处理NO2尾气的化学方程式___________ 。
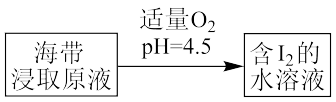
(4)海带提取碘下图所示步骤中反应的离子方程式___________ 。
(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式___________ 。
(1)制备粗硅的化学方程式
(2)碱性锌锰干电池的正极反应式
(3)用氢氧化钠溶液处理NO2尾气的化学方程式
(4)海带提取碘下图所示步骤中反应的离子方程式

(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___________ (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为___________ 。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_____ 。
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式_____ 。

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是___________ 。
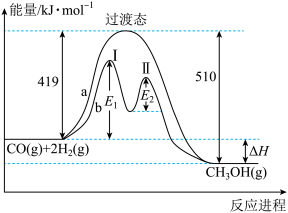
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
您最近一年使用:0次
2021-07-14更新
|
649次组卷
|
3卷引用:江西省景德镇一中2020-2021学年高一下学期期末考试化学试题
江西省景德镇一中2020-2021学年高一下学期期末考试化学试题湖北省襄阳市第一中学2022-2023学年高一下学期4月月考化学试题(已下线)易错点20 化学反应机理-备战2023年高考化学考试易错题
名校
7 . 2021年6月17日,搭载神舟十二号载人飞船的长征二号F摇十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼(C2H8N2)、四氧化二氮和液氢、液氧两种。
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
由以上数据可求得2NH3(g)⇌N2(g)+3H2(g)∆H=_______ 。
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是_______ 。
A.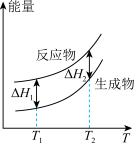 B.
B. 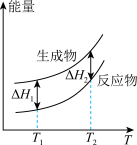 C.
C. 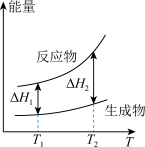 D.
D.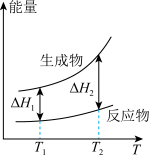
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=_______ 。
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式_______ 。
(5)对C2H8N2和N2O4反应的说法正确的是_______ 。
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
| 化学键 | N≡N | H—H | N—H |
| 键能E(kJ/mol) | 946.0 | 436.0 | 390.8 |
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是
A.
 B.
B.  C.
C.  D.
D.
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式
(5)对C2H8N2和N2O4反应的说法正确的是
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
您最近一年使用:0次
解题方法
8 . 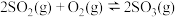 为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:
(1)已知该反应在反应过程中体系温度会升高,且每摩尔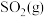 、
、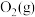 、
、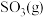 所含化学能分别为
所含化学能分别为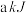 、
、 、
、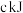 ,则每有
,则每有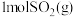 参与反应时,
参与反应时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(2)一定温度下,向体积为2L的刚性密闭容器中充入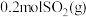 和
和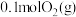 ,发生反应:
,发生反应: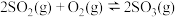 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如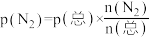 。
。
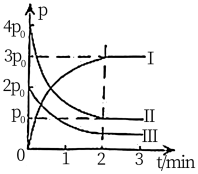
①图中表示 分压变化的曲线为
分压变化的曲线为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”);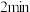 时,
时, 的转化率为
的转化率为_______ 。
② 内,用
内,用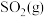 表示该反应的速率为
表示该反应的速率为_______  。
。
③能说明上述反应已达到平衡状态的是_______ (填选项字母)。
a.容器内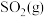 、
、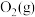 的物质的量浓度之比为
的物质的量浓度之比为
b.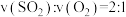
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
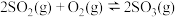 为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:(1)已知该反应在反应过程中体系温度会升高,且每摩尔
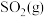 、
、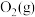 、
、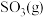 所含化学能分别为
所含化学能分别为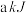 、
、 、
、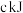 ,则每有
,则每有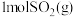 参与反应时,
参与反应时, 。
。(2)一定温度下,向体积为2L的刚性密闭容器中充入
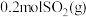 和
和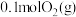 ,发生反应:
,发生反应: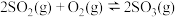 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如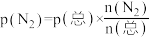 。
。
①图中表示
 分压变化的曲线为
分压变化的曲线为 时,
时, 的转化率为
的转化率为②
 内,用
内,用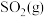 表示该反应的速率为
表示该反应的速率为 。
。③能说明上述反应已达到平衡状态的是
a.容器内
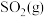 、
、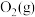 的物质的量浓度之比为
的物质的量浓度之比为
b.
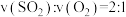
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
您最近一年使用:0次
解题方法
9 . 回答下列问题:
I.已知:①N2(g)+O2(g)=2NO(g) ΔH=+l80.5 kJ·mol-1
②C(S)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
(1)上述反应中属于放热反应的是_______ (填序号,下同),属于吸热反应的是_______ 。
(2)24 g固体碳粉完全燃烧生成CO2放出热量_______ kJ。
(3)已知NO和CO完全反应产生CO2和N2,请写出该反应的热化学方程式_______
Ⅱ.某温度时,在一个2 L的恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。回答下列问题:
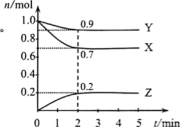
(4)化学方程式为_______ ,从反应开始到2 min,v(X)=_______ 。
(5)t为2 min时的压强是开始时压强的_______ 倍。
(6)下列说法中正确的是_______ (填选项)。
A.2v(X)=v(Z)
B.反应过程中,容器内压强先减小后不变
C.t=2 min时,X,Y的转化率相等
D.反应过程中,容器内混合气体的密度一直保持不变
I.已知:①N2(g)+O2(g)=2NO(g) ΔH=+l80.5 kJ·mol-1
②C(S)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
(1)上述反应中属于放热反应的是
(2)24 g固体碳粉完全燃烧生成CO2放出热量
(3)已知NO和CO完全反应产生CO2和N2,请写出该反应的热化学方程式
Ⅱ.某温度时,在一个2 L的恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。回答下列问题:

(4)化学方程式为
(5)t为2 min时的压强是开始时压强的
(6)下列说法中正确的是
A.2v(X)=v(Z)
B.反应过程中,容器内压强先减小后不变
C.t=2 min时,X,Y的转化率相等
D.反应过程中,容器内混合气体的密度一直保持不变
您最近一年使用:0次
10 . 科学家致力于二氧化碳甲烷化研究,期待早日实现“碳中和”的愿景。下列关于二氧化碳甲烷化技术的说法错误的是
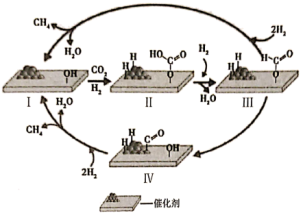

A.I→II的反应方程式为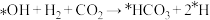 ( ( 代表吸附态) 代表吸附态) |
| B.II→III的过程中有C—O键的断裂也有O—H键形成 |
| C.III→I存在两种路径,这两种路径中III与I的能量差值不同 |
D.每生成1mol 转移电子数为8 转移电子数为8 |
您最近一年使用:0次
2021-07-08更新
|
738次组卷
|
3卷引用:福建省厦门市2020-2021学年高一下学期期末考试化学试题



