名校
解题方法
1 . 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
反应1:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1
反应2:CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1
(1)1mol CH4还原NO2至N2,写出该过程的热化学方程式___________ 。
(2)用CH4催化还原NO,能提高N2的平衡产率的措施是___________(填字母)。
(3)一定温度下,在初始体积为2L恒容密闭容器中通入1mol CH4和4mol NO(假设只发生反应2)。
①下列能说明该反应已经达到平衡状态的是___________ (填字母)。
A.c(CH4)和c(CO2)的浓度比保持不变 B.混合气体的密度保持不变
C.CH4的消耗速率等于CO2的消耗速率 D.容器内气体压强保持不变
② 后该反应达到平衡,测得容器中N2的物质的量为
后该反应达到平衡,测得容器中N2的物质的量为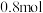 。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=___________ 。
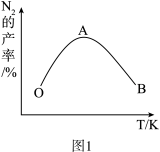
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,反应相同时间,测得N2的产率与温度的关系如图1所示,OA段N2产率随温度升高而增大的原因是___________ 。
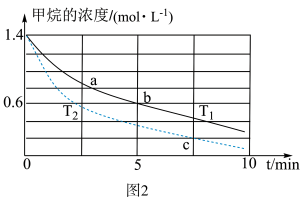
(5)对于反应2而言,不同温度下,CH4的浓度变化如图2所示,下列说法正确的是___________(填字母)。
反应1:CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1反应2:CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1(1)1mol CH4还原NO2至N2,写出该过程的热化学方程式
(2)用CH4催化还原NO,能提高N2的平衡产率的措施是___________(填字母)。
| A.升高温度 | B.增大压强 | C.降低温度 | D.降低压强 |
①下列能说明该反应已经达到平衡状态的是
A.c(CH4)和c(CO2)的浓度比保持不变 B.混合气体的密度保持不变
C.CH4的消耗速率等于CO2的消耗速率 D.容器内气体压强保持不变
②
 后该反应达到平衡,测得容器中N2的物质的量为
后该反应达到平衡,测得容器中N2的物质的量为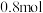 。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,反应相同时间,测得N2的产率与温度的关系如图1所示,OA段N2产率随温度升高而增大的原因是

(5)对于反应2而言,不同温度下,CH4的浓度变化如图2所示,下列说法正确的是___________(填字母)。

| A.T1大于T2 |
| B.c点二氧化碳的浓度为0.2 mol·L-1 |
| C.a点正反应速率大于b点的正反应速率 |
| D.a点的反应速率一定比c点的反应速率小 |
您最近一年使用:0次
2023-04-30更新
|
166次组卷
|
2卷引用:江苏省连云港市东海县2022-2023学年高二上学期期中考试化学试题
22-23高二上·江苏南通·期末
名校
解题方法
2 .  催化加氢合成甲醇是重要的碳捕获利用与封存技术。
催化加氢合成甲醇是重要的碳捕获利用与封存技术。 催化加氢主要反应有:
催化加氢主要反应有:
反应I.
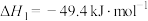
反应II.

压强分别为 、
、 时,将
时,将 的混合气体置于密闭容器中反应,不同温度下体系中
的混合气体置于密闭容器中反应,不同温度下体系中 的平衡转化率和
的平衡转化率和 、CO的选择性如图所示。
、CO的选择性如图所示。
 (或CO)的选择性
(或CO)的选择性
 催化加氢合成甲醇是重要的碳捕获利用与封存技术。
催化加氢合成甲醇是重要的碳捕获利用与封存技术。 催化加氢主要反应有:
催化加氢主要反应有:反应I.

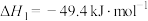
反应II.


压强分别为
 、
、 时,将
时,将 的混合气体置于密闭容器中反应,不同温度下体系中
的混合气体置于密闭容器中反应,不同温度下体系中 的平衡转化率和
的平衡转化率和 、CO的选择性如图所示。
、CO的选择性如图所示。 (或CO)的选择性
(或CO)的选择性

A.反应 为吸热反应 为吸热反应 |
B.曲线③、④表示CO的选择性,且 |
C.相同温度下,反应I、II的平衡常数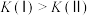 |
D.一定温度下,调整 ,可提高 ,可提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
2023-01-16更新
|
787次组卷
|
7卷引用:江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题11-14)
(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题11-14)江苏省南通市2022-2023学年高二上学期1月期末考试化学试题江苏省海安高级中学2022-2023学年高三下学期3月月考化学试题江苏省盐城市五校2022-2023学年高二下学期5月联考化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省锡东高级中学2023-2024学年高二下学期3月月考化学试题江苏省徐州市沛县第二中学2023-2024学年高三下学期开学化学试题
名校
3 . 恒压条件下,密闭容器中将CO2、H2按照体积比为1:3合成CH3OH,其中涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1= -49kJ·mol-l
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2= 41kJ·mol-l
在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图

已知:CH3OH的选择性=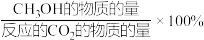
下列说法正确的是
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1= -49kJ·mol-l
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2= 41kJ·mol-l
在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图

已知:CH3OH的选择性=
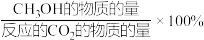
下列说法正确的是
A.反应 CO(g)+2H2(g) CH3OH(g) △H= 90kJ·mol-1 CH3OH(g) △H= 90kJ·mol-1 |
| B.合成甲醇的适宜工业条件是290℃,催化剂选择CZ(Zr-1)T |
| C.230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是230℃以上,升温对反应Ⅱ的影响更大 |
| D.保持恒压恒温下充入氦气,不影响CO2的转化率 |
您最近一年使用:0次
2022-12-17更新
|
599次组卷
|
4卷引用:江苏省靖江市2022-2023学年高三上学期调研测试化学试题
4 . 在压强、 和
和 起始投料一定的条件下,通过催化剂催化发生反应:
起始投料一定的条件下,通过催化剂催化发生反应:
反应Ⅰ.
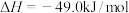
反应Ⅱ.
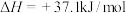
实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性[
的选择性[ 的选择性
的选择性 ]随温度的变化如图所示。下列说法正确的是
]随温度的变化如图所示。下列说法正确的是
 和
和 起始投料一定的条件下,通过催化剂催化发生反应:
起始投料一定的条件下,通过催化剂催化发生反应:反应Ⅰ.

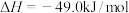
反应Ⅱ.

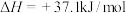
实验测得
 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性[
的选择性[ 的选择性
的选择性 ]随温度的变化如图所示。下列说法正确的是
]随温度的变化如图所示。下列说法正确的是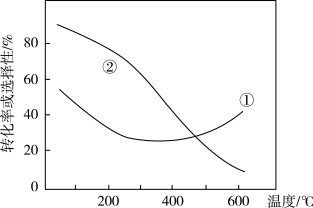
A.曲线②表示 的平衡转化率 的平衡转化率 |
B.平衡时,其他条件不变,适当升高温度 的选择性增大 的选择性增大 |
C.相同条件下,反应 的焓变 的焓变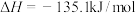 |
D.选择在低温低压条件,能同时提高 的平衡转化率和平衡时 的平衡转化率和平衡时 的选择性 的选择性 |
您最近一年使用:0次
2022-11-30更新
|
192次组卷
|
3卷引用:江苏省南通市海安市实验中学2022-2023学年高二上学期期中考试化学试题
江苏省南通市海安市实验中学2022-2023学年高二上学期期中考试化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题11-14)江苏省镇江市六校联考2023-2024学年高二下学期3月月考化学试题
名校
解题方法
5 . 已知: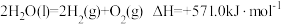 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
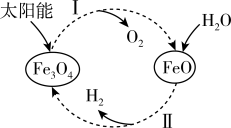
过程Ⅰ:
过程Ⅱ:……
下列说法正确的是
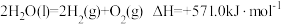 。以太阳能为热源分解
。以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下:
的过程如下:
过程Ⅰ:

过程Ⅱ:……
下列说法正确的是
A. 起催化剂的作用,在反应过程中化学性质不发生改变 起催化剂的作用,在反应过程中化学性质不发生改变 |
B.过程Ⅰ中每消耗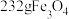 转移4mol电子 转移4mol电子 |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
D.过程Ⅱ的热化学方程式为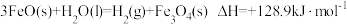 |
您最近一年使用:0次
2022-11-05更新
|
429次组卷
|
6卷引用:江苏省扬州中学2022-2023学年高二上学期12月月考化学试题
名校
6 . 丙烷经催化脱氢制丙烯的反应为 。600℃,将固定浓度的
。600℃,将固定浓度的 通入有催化剂的恒容反应器,逐渐提高
通入有催化剂的恒容反应器,逐渐提高 浓度,经相同时间,测得出口处
浓度,经相同时间,测得出口处 、CO和
、CO和 浓度随初始
浓度随初始 浓度的变化关系如图。已知:
浓度的变化关系如图。已知:

①

②

③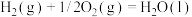

下列说法正确的是
 。600℃,将固定浓度的
。600℃,将固定浓度的 通入有催化剂的恒容反应器,逐渐提高
通入有催化剂的恒容反应器,逐渐提高 浓度,经相同时间,测得出口处
浓度,经相同时间,测得出口处 、CO和
、CO和 浓度随初始
浓度随初始 浓度的变化关系如图。已知:
浓度的变化关系如图。已知:
①


②


③
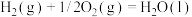

下列说法正确的是
A.丙烷催化脱氢制丙烯反应的 |
B. 和 和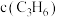 变化差异的原因: 变化差异的原因: |
C.其他条件不变,投料比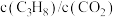 越大, 越大, 转化率越大 转化率越大 |
D.若体系只有 、 、 、CO和 、CO和 生成,则出口处物质浓度c之间一定存在关系: 生成,则出口处物质浓度c之间一定存在关系: |
您最近一年使用:0次
2022-11-05更新
|
172次组卷
|
2卷引用:江苏省常州市2022-2023学年高三上学期期中考试化学试题
名校
解题方法
7 . 工业上利用碳热还原 制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。

已知:碳热还原 过程中可能发生下列反应。
过程中可能发生下列反应。
ⅰ.

ⅱ.
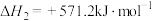

ⅲ.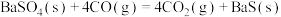
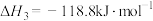

下列关于碳热还原 过程的说法正确的是
过程的说法正确的是
 制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
已知:碳热还原
 过程中可能发生下列反应。
过程中可能发生下列反应。ⅰ.


ⅱ.

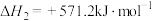

ⅲ.
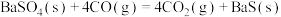
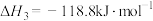

下列关于碳热还原
 过程的说法正确的是
过程的说法正确的是A.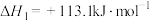 , ,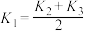 |
B.400℃后,反应后组分的变化是由 的移动导致的 的移动导致的 |
C.温度升高, 的平衡常数K减小 的平衡常数K减小 |
D.反应过程中,生成的 和CO的物质的量之和始终等于投入C的物质的量 和CO的物质的量之和始终等于投入C的物质的量 |
您最近一年使用:0次
2022-09-14更新
|
223次组卷
|
3卷引用:江苏省南通市海安市实验中学2022-2023学年高二上学期9月月考化学试题
8 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕捉和碳利用技术则是关键。通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)已知:CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
 (g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1
(g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1
HOCH2CH2OH(g) + H2(g) → C2H5OH(g) + H2O(g) ∆H2=−94.8kJ∙mol−1
获取乙二醇的反应历程可分为如下2步:
I. (g)+CO2(g)→
(g)+CO2(g)→ 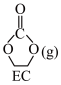 ∆H3=−60.3kJ∙mol−1
∆H3=−60.3kJ∙mol−1
II.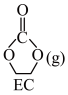 +3H2(g)
+3H2(g) HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4
HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4
①步骤II中 ∆H4=___________ 。
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
由上表可知,温度越高,EC的转化率越高,原因是___________ 。温度升高到220℃时,乙二醇的产率反而降低,原因是_____ 。
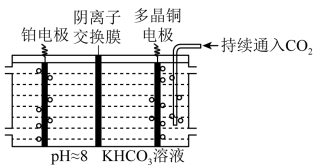
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____
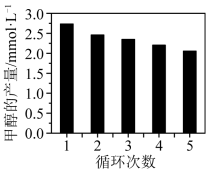
(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_______ (已知Co的性质与Fe相似)
(1)已知:CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
 (g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1
(g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1HOCH2CH2OH(g) + H2(g) → C2H5OH(g) + H2O(g) ∆H2=−94.8kJ∙mol−1
获取乙二醇的反应历程可分为如下2步:
I.
 (g)+CO2(g)→
(g)+CO2(g)→  ∆H3=−60.3kJ∙mol−1
∆H3=−60.3kJ∙mol−1II.
 +3H2(g)
+3H2(g) HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4
HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4①步骤II中 ∆H4=
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
| 反应温度/℃ | EC转化率/% | 乙二醇产率/% |
| 160 | 23.8 | 23.2 |
| 180 | 62.1 | 60.9 |
| 200 | 99.9 | 94.7 |
| 220 | 99.9 | 92.4 |
由上表可知,温度越高,EC的转化率越高,原因是
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因

您最近一年使用:0次
名校
9 . 黄铁矿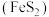 是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化: 。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有:
。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有: ;
; 。
。 的反应机理如下:
的反应机理如下:
反应Ⅰ: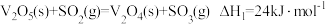
反应Ⅱ:
反应中的能量变化如题图,下列说法不正确的是

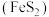 是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化: 。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有:
。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有: ;
; 。
。 的反应机理如下:
的反应机理如下:反应Ⅰ:
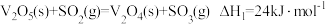
反应Ⅱ:

反应中的能量变化如题图,下列说法不正确的是

A. | B.反应Ⅰ的 |
C.通入过量空气,可提高 的平衡转化率 的平衡转化率 | D.反应速率由反应Ⅰ决定 |
您最近一年使用:0次
2022-09-13更新
|
282次组卷
|
2卷引用:江苏省扬州市江都区邵伯高级中学2022-2023学年高三上学期期初考试化学试题
名校
10 . CO2的固定、利用有利于缓解温室效应和人类的可持续发展。
(1)我国科研人员发现,320℃左右时,在新型纳米催化剂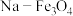 和
和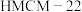 的表面可以将CO2和H2转化为烷烃X,其过程如图所示。
的表面可以将CO2和H2转化为烷烃X,其过程如图所示。
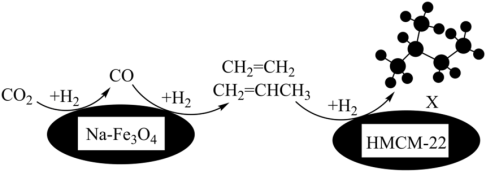
①用系统命名法命名X:_______ 。
②已知: △H = 41 kJ/mol
△H = 41 kJ/mol
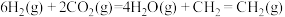 △H = -128 kJ/mol
△H = -128 kJ/mol
写出 气体转化为乙烯的热化学方程式:
气体转化为乙烯的热化学方程式:_______ 。
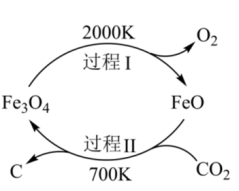
(2)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图所示。过程Ⅱ反应的化学方程式是_______
(3)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36 L (标准状况下) O2,则电路中转移的电子至少_______ mol。
②生成乙烯的电极反应式是_______ 。
(1)我国科研人员发现,320℃左右时,在新型纳米催化剂
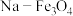 和
和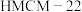 的表面可以将CO2和H2转化为烷烃X,其过程如图所示。
的表面可以将CO2和H2转化为烷烃X,其过程如图所示。
①用系统命名法命名X:
②已知:
 △H = 41 kJ/mol
△H = 41 kJ/mol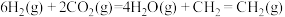 △H = -128 kJ/mol
△H = -128 kJ/mol写出
 气体转化为乙烯的热化学方程式:
气体转化为乙烯的热化学方程式:(2)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图所示。过程Ⅱ反应的化学方程式是

(3)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36 L (标准状况下) O2,则电路中转移的电子至少
②生成乙烯的电极反应式是
您最近一年使用:0次



