1 . H2与O2发生反应的过程用模型图表示如下(“—”表示化学键)。下列说法错误的是
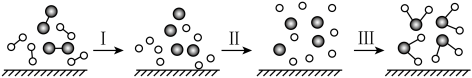

| A.过程I是吸热过程 |
| B.该过程是旧化学键断裂,新化学键形成的过程 |
| C.过程III是放热过程 |
| D.该反应只能以热能的形式进行能量转化 |
您最近一年使用:0次
2022-12-19更新
|
723次组卷
|
49卷引用:福建省福州市连江第五中学2020-2021学年高一下学期第一次质量检测化学试题
福建省福州市连江第五中学2020-2021学年高一下学期第一次质量检测化学试题山东省济南市长清第一中学2020-2021学年高一下学期期中质量检测化学试题江苏省苏州外国语中学2020-2021学年高二下学期3月月考化学试题山东德州齐河县第一中学2020-2021学年高一下学期期中化学试题云南省玉溪市峨山县第一中学2020-2021学年高二下学期期中考试化学试题(已下线)期末综合检测卷03【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)(已下线)专题1.1.1 反应热与焓变(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)黑龙江省大庆市肇州县二校2020-2021学年高二下学期期末联考化学试题(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)辽宁省大连市2021-2022学年高二上学期期中考试化学试题重庆市朝阳中学2021-2022学年高二上学期期中考试化学试题黑龙江省鸡东县第二中学2021-2022学年高二上学期期中考试化学(理)试题浙江省温州市平阳县万全综合高级中学2021-2022学年高二上学期期中考试化学试题宁夏银川市景博中学2021-2022学年高二上学期期中考试化学试题安徽省太和县第八中学2021-2022学年高二上学期第一次月考化学试题陕西省安康市汉滨区江北高级中学2021-2022学年高二上学期第一次阶段性检测化学试题(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷2014--2015辽宁省葫芦岛市高一下学期省五校协作体期中化学试卷2015-2016学年湖北省武汉二中高二上学期期末化学试卷河南省濮阳市2016-2017学年高二下学期升级(期末)考试(B卷)化学试题浙江省诸暨市牌头中学2017-2018学年高一下学期期中考试(A)化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题1河南省周口市中英文学校2018-2019学年高二上学期第一次月考化学试题高二人教版选修4 第一章 章末知识测评(一)(已下线)2019年8月20日《每日一题》选修4—— 吸热反应与放热反应的判断(已下线)2019年8月25日 《每日一题》选修4——每周一测百所名校联考-化学反应与能量湖南怀化中方县一中2019-2020学年高二9月月考化学试卷宁夏银川一中2019-2020学年高二上学期期中考试化学试题河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科培优班)试题西藏自治区日喀则市南木林高级中学2019-2020学年高二上学期期中化学试题湖南省张家界市2019-2020学年高二上学期期末考试化学试题人教版高中化学必修2第二章《化学反应与能量》检测题江苏省苏州市2019-2020学年高二下学期期中考试化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题(已下线)1.1.1 反应热 焓变(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省济宁市微山一中2020-2021学年高二上学期第一次月考化学试题河南省南阳市第十中学2020-2021学年高二上学期第一次月考化学试题山东省临沂市平邑县、沂水县2020~2021学年高二上学期期中联考化学试题河北省唐山市遵化市2020-2021学年高二上学期期中考试化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题浙江省宁波市北仑中学2021-2022学年高一下学期期中考试化学试题(学考)河北省秦皇岛市卢龙县第二高级中学2021-2022学年高二上学期期末考试化学试题四川省凉山州宁南中学2022-2023学年高二上学期第一次月考化学试题海南省三亚华侨学校南新校区2022-2023学年高二上学期开学摸底考试化学试题 四川省青神中学校2022-2023学年高二下学期3月月考化学试题辽宁省沈阳市郊校2022-2023学年高一下学期4月联考化学试题
名校
2 . 下列依据热化学方程式得出的结论正确的是
| A.在25℃、101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol。 |
B.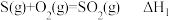 ; ;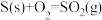  ,则 ,则 > > |
C.在稀溶液中: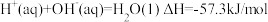 ,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| D.已知C(石墨,S)=C(金刚石,S) △H=+1.9kJ/mol,则金刚石比石墨稳定 |
您最近一年使用:0次
2022-12-18更新
|
257次组卷
|
3卷引用:广西百色民族高级中学2021-2022学年高二上学期9月月考化学试题
解题方法
3 . 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图象,然后回答问题:
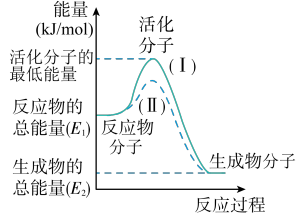
(1)图中所示反应是_______ (填“吸热”或“放热”)反应,该反应的ΔH=_______ (用含E1、E2的代数式表示);
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_______ 。
(3)已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1_______ ΔH2(填“>”“<”或“=”)。
(4)在25℃、101kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是_______。

(1)图中所示反应是
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是
(3)已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1
(4)在25℃、101kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是_______。
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
您最近一年使用:0次
解题方法
4 . 现有反应:①Ba(OH)2∙8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O②Fe+H2SO4=FeSO4+H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是_______ (填序号,下同),能设计成原电池的是_______ 。
(2)Fe-Cu原电池的装置如图所示。
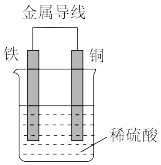
①铁作_______ (填“正极”或“负极”),溶液中H+向_______ (填“铁”或“铜”)电极方向移动。
②正极的现象是_______ ,负极的电极反应式为_______ 。
(1)两反应中属于吸热反应的是
(2)Fe-Cu原电池的装置如图所示。

①铁作
②正极的现象是
您最近一年使用:0次
解题方法
5 . 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用
(1)肼(N2H4)可作为火箭发动机的燃料。肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为______ kJ,写出肼(l)和N2O4(l)反应的热化学方程式:_____________________ 。
(2)肼一空气燃料电池是一种碱性电池(产物无污染),该电池放电时,负极的电极反应式为________ 。
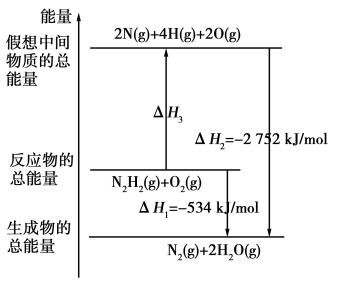
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则ΔH3=________ ,断裂1 mol N—H键所需的能量是________ kJ。
(1)肼(N2H4)可作为火箭发动机的燃料。肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为
(2)肼一空气燃料电池是一种碱性电池(产物无污染),该电池放电时,负极的电极反应式为
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则ΔH3=

您最近一年使用:0次
6 . 联氨(N2H4)常温下为无色液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=﹣1048.9 kJ·mol−1
下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=﹣1048.9 kJ·mol−1
下列说法不正确的是
| A.O2(g)+2H2(g)=2H2O(l) ΔH5,ΔH5>ΔH3 |
| B.ΔH4=2ΔH3﹣2ΔH2﹣ΔH1 |
| C.1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g) |
| D.联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热 |
您最近一年使用:0次
2022-12-10更新
|
123次组卷
|
2卷引用:河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期9月月考化学试题
解题方法
7 . 反应C(石墨) → C(金刚石)是吸热反应,由此可知
| A.石墨比金刚石更稳定 | B.金刚石和石墨可以相互转化 |
| C.金刚石比石墨稳定 | D.金刚石和石墨不能相互转化 |
您最近一年使用:0次
解题方法
8 . 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
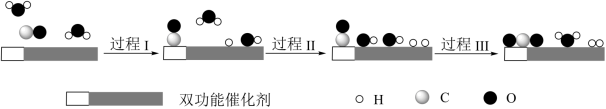
下列说法正确的是
 CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
| A.过程Ⅰ、过程Ⅱ均为放热过程 |
| B.使用催化剂降低了水煤气变换反应的ΔH |
| C.图示显示:起始时的2个H2O最终都参与了反应 |
| D.该催化过程中:只有极性键的断裂和形成 |
您最近一年使用:0次
名校
解题方法
9 . 生产生活中的化学反应都伴随能量的变化,请回答下列问题。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
写出该反应的热化学方程式:___________
(3)汽车尾气中排放的 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:
Ⅰ.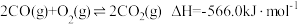
Ⅱ.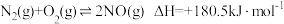
Ⅲ.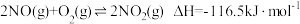
① 的燃烧热为
的燃烧热为___________  。
。
② 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为___________ 。
③下图是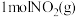 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。


(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为___________ 。
②在操作正确的前提下,提高中和热测定准确性的关键是___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用
(2)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 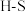 |  |  |  中共价键 中共价键 |
键能/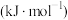 | 339 | 498 | 464 | 1083 |
写出该反应的热化学方程式:
(3)汽车尾气中排放的
 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:Ⅰ.
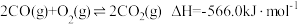
Ⅱ.
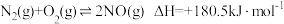
Ⅲ.
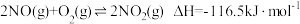
①
 的燃烧热为
的燃烧热为 。
。②
 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为③下图是
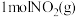 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是

(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为
②在操作正确的前提下,提高中和热测定准确性的关键是
您最近一年使用:0次
解题方法
10 . 化学反应伴随着能量变化,下列说法正确的是
| A.需要加热的反应一定是吸热反应,不需要加热的反应一定是放热反应 |
B.单质硫燃烧热的热化学方程式:S(s)+ O2(g)=SO3(g) ΔH=a kJ·mol-1 O2(g)=SO3(g) ΔH=a kJ·mol-1 |
C.C(s,石墨) C(s,金刚石) ΔH=+1.9 kJ·mol-1,由此推断石墨比金刚石稳定 C(s,金刚石) ΔH=+1.9 kJ·mol-1,由此推断石墨比金刚石稳定 |
| D.已知:2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次



