解题方法
1 . 我国科学家以二氧化碳为原料,通过全合成方法成功制得了淀粉,取得了科技领域的一个重大突破。以 为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原
为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原 的过程中可同时发生反应①②。
的过程中可同时发生反应①②。
①
②
(1)
___________ 。
(2)已知 时,反应能自发进行反应,反应①的
时,反应能自发进行反应,反应①的 ,则反应①自发进行的温度不超过
,则反应①自发进行的温度不超过___________ K(保留一位小数)。
(3)在恒温恒容密闭容器中,充入一定量的 及
及 ,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
已知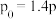 ,则表中
,则表中
___________ ;反应①的平衡常数
___________ 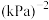 (用含p的代数式表示),
(用含p的代数式表示), 为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
(4)向恒压反应器中通入 和
和 ,
, 的平衡转化率及
的平衡转化率及 的平衡产率随温度变化的关系如图所示。已知:
的平衡产率随温度变化的关系如图所示。已知: 的产率
的产率 。
。 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是___________ 。
(5) 的综合利用有利于“碳中和”,
的综合利用有利于“碳中和”, 分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为
分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为___________ ,晶体的密度
___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数)。
为阿伏加德罗常数)。 的用途广泛,请写出一种与其物理性质相关的用途:
的用途广泛,请写出一种与其物理性质相关的用途:___________ 。
 为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原
为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原 的过程中可同时发生反应①②。
的过程中可同时发生反应①②。①

②

(1)

(2)已知
 时,反应能自发进行反应,反应①的
时,反应能自发进行反应,反应①的 ,则反应①自发进行的温度不超过
,则反应①自发进行的温度不超过(3)在恒温恒容密闭容器中,充入一定量的
 及
及 ,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
,起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:| n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(CO)/mol | n(H2O)/mol | 总压/ | |
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡 | m | 0.3 | p |
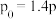 ,则表中
,则表中

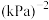 (用含p的代数式表示),
(用含p的代数式表示), 为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。(4)向恒压反应器中通入
 和
和 ,
, 的平衡转化率及
的平衡转化率及 的平衡产率随温度变化的关系如图所示。已知:
的平衡产率随温度变化的关系如图所示。已知: 的产率
的产率 。
。
 的平衡转化率随温度升高而增大的原因是
的平衡转化率随温度升高而增大的原因是(5)
 的综合利用有利于“碳中和”,
的综合利用有利于“碳中和”, 分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为
分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶胞中的原子总数为
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数)。
为阿伏加德罗常数)。
 的用途广泛,请写出一种与其物理性质相关的用途:
的用途广泛,请写出一种与其物理性质相关的用途:
您最近一年使用:0次
2 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=___________ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有___________ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应c、d、e的平衡均向右移动 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分
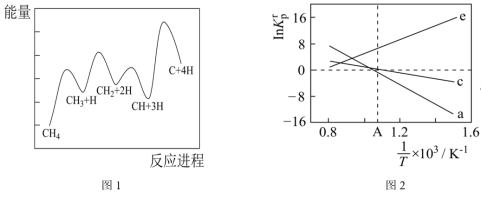
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
解题方法
3 . 硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: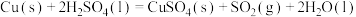
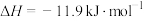 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
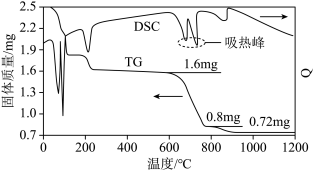
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
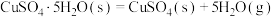



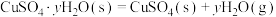

则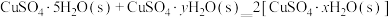 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: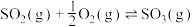
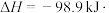

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
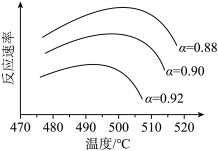
A.温度越高,反应速率越大 B. 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
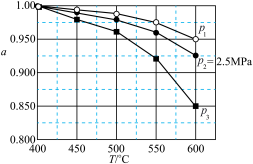
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为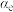 ,则上述催化氧化反应
,则上述催化氧化反应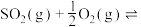
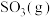 的
的
_____________ (用含p和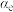 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: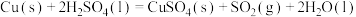
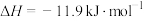 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
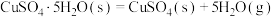



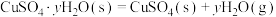

则
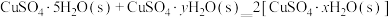 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: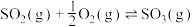
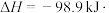

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
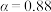 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为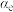 ,则上述催化氧化反应
,则上述催化氧化反应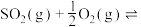
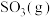 的
的
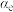 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
4 . 硫酸亚铁在工农业生产中有许多用途,如可用作农药,防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题。
(1)在 气氛中,
气氛中, (
( )的脱水热分解情况如表所示:
)的脱水热分解情况如表所示:
根据上述实验结果,可知
_______ 。
(2)已知下列热化学方程式:

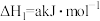

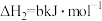


则 的
的
_______  。
。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: 。平衡时
。平衡时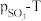 的关系如图所示。720K时,该反应的平衡总压
的关系如图所示。720K时,该反应的平衡总压
_______ kPa,平衡常数
_______ 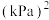 。
。 随反应温度升高而
随反应温度升高而_______ (填“增大”“减小”或“不变”)。

(4)提高温度,上述容器中进一步发生反应: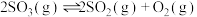 (Ⅱ),平衡时
(Ⅱ),平衡时
_______ (用 、
、 表示)。在929K时,
表示)。在929K时, ,
, ,则
,则
_______ kPa。
(1)在
 气氛中,
气氛中, (
( )的脱水热分解情况如表所示:
)的脱水热分解情况如表所示:| 加热温度/℃ | 失重比/% | 物质组成 |
| 100 | 19.4 |  |
| 200 | 38.8 |  |
| 300 | 45.3 |  |

(2)已知下列热化学方程式:

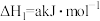

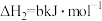


则
 的
的
 。
。(3)将
 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: 。平衡时
。平衡时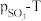 的关系如图所示。720K时,该反应的平衡总压
的关系如图所示。720K时,该反应的平衡总压

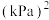 。
。 随反应温度升高而
随反应温度升高而
(4)提高温度,上述容器中进一步发生反应:
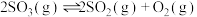 (Ⅱ),平衡时
(Ⅱ),平衡时
 、
、 表示)。在929K时,
表示)。在929K时, ,
, ,则
,则
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题
(1)已知:①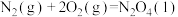
 kJ⋅mol
kJ⋅mol
②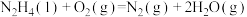
 kJ⋅mol
kJ⋅mol ;
;
写出液态肼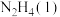 和
和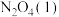 反应生成
反应生成 和水蒸气的热化学方程式:
和水蒸气的热化学方程式:__________________ 。
(2)用50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
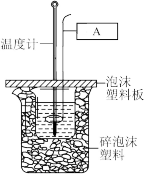
①中和热的测定装置如图所示。图中A的仪器名称:____________ 。
②用相同浓度和体积的氨水( )代替NaOH溶液进行上述实验,测得的中和热的数值会
)代替NaOH溶液进行上述实验,测得的中和热的数值会______ (填“偏大”、“偏小”、“无影响”)。
(3)CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5 L的体积不变的密闭容器内,加入0.3 mol的CO和0.3 mol的 ,在催化剂存在和800℃的条件下加热,发生如下反应:
,在催化剂存在和800℃的条件下加热,发生如下反应: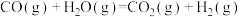
 ,反应中
,反应中 的浓度随时间变化情况如图:
的浓度随时间变化情况如图:
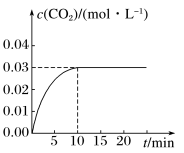
①根据图上数据,该温度(800℃)下的平衡常数
______ 。
②在催化剂存在和800℃的条件下,在某一时刻测得 mol⋅L
mol⋅L ;
;
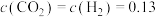 mol⋅L
mol⋅L ,则此时正、逆反应速率的大小:
,则此时正、逆反应速率的大小:
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅱ.还原法炼铅,包含反应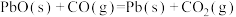
 ,该反应的平衡常数的对数值与温度的关系如表:
,该反应的平衡常数的对数值与温度的关系如表:
③当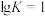 ,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为
,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______ (填“增大”“减小”或“不变”)。
(1)已知:①
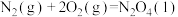
 kJ⋅mol
kJ⋅mol
②
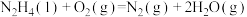
 kJ⋅mol
kJ⋅mol ;
;写出液态肼
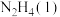 和
和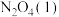 反应生成
反应生成 和水蒸气的热化学方程式:
和水蒸气的热化学方程式:(2)用50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

①中和热的测定装置如图所示。图中A的仪器名称:
②用相同浓度和体积的氨水(
 )代替NaOH溶液进行上述实验,测得的中和热的数值会
)代替NaOH溶液进行上述实验,测得的中和热的数值会(3)CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5 L的体积不变的密闭容器内,加入0.3 mol的CO和0.3 mol的
 ,在催化剂存在和800℃的条件下加热,发生如下反应:
,在催化剂存在和800℃的条件下加热,发生如下反应: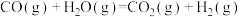
 ,反应中
,反应中 的浓度随时间变化情况如图:
的浓度随时间变化情况如图:
①根据图上数据,该温度(800℃)下的平衡常数

②在催化剂存在和800℃的条件下,在某一时刻测得
 mol⋅L
mol⋅L ;
;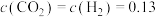 mol⋅L
mol⋅L ,则此时正、逆反应速率的大小:
,则此时正、逆反应速率的大小:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。Ⅱ.还原法炼铅,包含反应
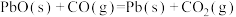
 ,该反应的平衡常数的对数值与温度的关系如表:
,该反应的平衡常数的对数值与温度的关系如表:| 温度/℃ | 300 | 727 | 1227 |
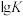 | 6.17 | 2.87 | 1.24 |
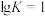 ,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为
,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为
您最近一年使用:0次
解题方法
6 . 金属钛(Ti)及其合金是高强度、低密度结构材料,在航空航天、医疗器械等领域有着重要用途。目前生产钛的方法之一是将TiO2转化为TiCl4,再进一步还原得到钛。
(1)TiO2转化为TiCl4有直接氯化法(反应a)和碳氯化法(反应b)。
a.TiO2(s) +2Cl2(g) TiCl4(g) +O2(g) ΔH1 =172 kJ·mol-1
TiCl4(g) +O2(g) ΔH1 =172 kJ·mol-1
b.TiO2(s) +2Cl2(g)+2C (s) TiCl4(g)+2CO (g) ΔH2
TiCl4(g)+2CO (g) ΔH2
已知:C (s) +O2(g) CO2(g) ΔH3= -393.5 kJ·mol-1,2CO (g) +O2(g)
CO2(g) ΔH3= -393.5 kJ·mol-1,2CO (g) +O2(g)  2CO2(g) ΔH4= - 566.0 kJ·mol-1
2CO2(g) ΔH4= - 566.0 kJ·mol-1
①直接氯化反应在___________ (填“高温”“低温”)有利于自发进行。
②ΔH2=___________ kJ·mol-1
③碳氯化法中生成CO比生成CO2更有利于TiO2转化为TiCl4,从熵变角度分析可能的原因是___________ 。
④已知常压下TCl4的沸点为136°C,从碳氯化反应的混合体系中分离出TiCl4的措施是___________ 。
(2)在1. 0 ×105Pa,将TiO2、C、Cl2以物质的量比1:2.2:2进行反应。体系中TiCl4、CO、CO2平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①已知在200°C平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
②图中a曲线代表的物质是___________ , 原因是___________ 。
③反应C (s)+CO2(g) 2CO (g)的平衡常数Kp(1200°C)=
2CO (g)的平衡常数Kp(1200°C)=___________ Pa。
(1)TiO2转化为TiCl4有直接氯化法(反应a)和碳氯化法(反应b)。
a.TiO2(s) +2Cl2(g)
 TiCl4(g) +O2(g) ΔH1 =172 kJ·mol-1
TiCl4(g) +O2(g) ΔH1 =172 kJ·mol-1b.TiO2(s) +2Cl2(g)+2C (s)
 TiCl4(g)+2CO (g) ΔH2
TiCl4(g)+2CO (g) ΔH2已知:C (s) +O2(g)
 CO2(g) ΔH3= -393.5 kJ·mol-1,2CO (g) +O2(g)
CO2(g) ΔH3= -393.5 kJ·mol-1,2CO (g) +O2(g)  2CO2(g) ΔH4= - 566.0 kJ·mol-1
2CO2(g) ΔH4= - 566.0 kJ·mol-1①直接氯化反应在
②ΔH2=
③碳氯化法中生成CO比生成CO2更有利于TiO2转化为TiCl4,从熵变角度分析可能的原因是
④已知常压下TCl4的沸点为136°C,从碳氯化反应的混合体系中分离出TiCl4的措施是
(2)在1. 0 ×105Pa,将TiO2、C、Cl2以物质的量比1:2.2:2进行反应。体系中TiCl4、CO、CO2平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①已知在200°C平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
②图中a曲线代表的物质是
③反应C (s)+CO2(g)
 2CO (g)的平衡常数Kp(1200°C)=
2CO (g)的平衡常数Kp(1200°C)=
您最近一年使用:0次
名校
7 . I.氢叠氮酸( )和莫尔盐[
)和莫尔盐[ ]是两种常用原料。
]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为
①0.2mol/L的 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和 分子浓度由大到小的顺序为
分子浓度由大到小的顺序为___________ 。
②已知T℃时,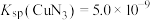 ,
,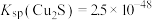 ,则相同温度下,
,则相同温度下, 该反应正反应方向
该反应正反应方向___________ (“能”或“不能”) 基本进行彻底,请通过计算说明___________ 。
(2)在 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
滴定终点的现象是___________ ,通过实验数据,计算该产品的纯度为___________ (用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是___________ 。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
II.锌及其化合物用途广泛。回答下列问题
(3)火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:


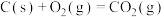
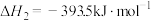

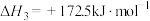

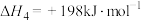
反应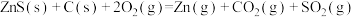 的
的
___________ kJ∙mol-1。
(4)银锌蓄电池工作原理为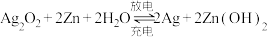 ,该蓄电池充电时,发生还原反应的物质是
,该蓄电池充电时,发生还原反应的物质是___________ ,正极反应分为两个阶段,第二阶段为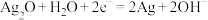 ,请写出第一阶段正极电极反应式
,请写出第一阶段正极电极反应式___________ 。
(5)以(4)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是___________ (用相关的电极反应式和离子方程式表示)。
 )和莫尔盐[
)和莫尔盐[ ]是两种常用原料。
]是两种常用原料。(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为

①0.2mol/L的
 溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和
溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和 分子浓度由大到小的顺序为
分子浓度由大到小的顺序为②已知T℃时,
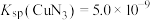 ,
,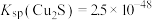 ,则相同温度下,
,则相同温度下, 该反应正反应方向
该反应正反应方向(2)在
 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
II.锌及其化合物用途广泛。回答下列问题
(3)火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:


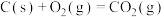
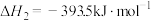

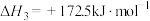

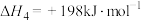
反应
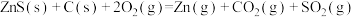 的
的
(4)银锌蓄电池工作原理为
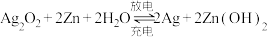 ,该蓄电池充电时,发生还原反应的物质是
,该蓄电池充电时,发生还原反应的物质是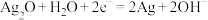 ,请写出第一阶段正极电极反应式
,请写出第一阶段正极电极反应式(5)以(4)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是

您最近一年使用:0次
8 . 合成气是一种以H2和CO为主的化工原料气,其用途广泛、廉价、清洁,可以合成许多化工产品。
(1)由CH4、CO2制合成气的主要反应有:
I.CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
II.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
III.CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+206.1kJ•mol-1
CO(g)+3H2(g) △H3=+206.1kJ•mol-1
IV.CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
①△H4=______ kJ•mol-1。
②用Ni基双金属催化反应III,反应的活化能降低,△H3______ (填“变大”、“变小”或“不变”)。
(2)一定条件下,向1L密闭容器中充入等物质的量的CO2和CH4,在催化剂作用下只发生反应II,反应控制其它条件不变,改变温度(T)对合成气中甲烷质量分数的影响如图:

若充入amolCH4,经过2小时后达到A点,2小时内用CH4表示的平均反应速率v(CH4)=______ mol•L-1•h-1(用含a的式子表示)。假设A为平衡态,此时压强为1MPa,则该反应的平衡常数Kp=______ (MPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)不同温度下,向体积为VL的含少量O2的密闭容器中按照n(CO2):n(CH4)=1投料,实验测得平衡时 随温度(T)的变化关系如图1所示:
随温度(T)的变化关系如图1所示:

①压强p1、p2、p3由大到小的顺序为_____ 。
②压强为p2时,随着温度升高, 先增大后减小。解释温度Tm前后,随着温度升高
先增大后减小。解释温度Tm前后,随着温度升高 变化的原因分别是
变化的原因分别是______ 。
③根据图1、图2分析,为提高CO的选择性(即CO在合成气中的体积分数)可采取的措施是______ (填字母)。
A.提高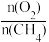 比例 B.降低
比例 B.降低 比例 C.高温、高压 D.低温、低压
比例 C.高温、高压 D.低温、低压
(1)由CH4、CO2制合成气的主要反应有:
I.CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1II.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1III.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H3=+206.1kJ•mol-1
CO(g)+3H2(g) △H3=+206.1kJ•mol-1IV.CO2(g)+H2(g)
 CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4①△H4=
②用Ni基双金属催化反应III,反应的活化能降低,△H3
(2)一定条件下,向1L密闭容器中充入等物质的量的CO2和CH4,在催化剂作用下只发生反应II,反应控制其它条件不变,改变温度(T)对合成气中甲烷质量分数的影响如图:

若充入amolCH4,经过2小时后达到A点,2小时内用CH4表示的平均反应速率v(CH4)=
(3)不同温度下,向体积为VL的含少量O2的密闭容器中按照n(CO2):n(CH4)=1投料,实验测得平衡时
 随温度(T)的变化关系如图1所示:
随温度(T)的变化关系如图1所示:
①压强p1、p2、p3由大到小的顺序为
②压强为p2时,随着温度升高,
 先增大后减小。解释温度Tm前后,随着温度升高
先增大后减小。解释温度Tm前后,随着温度升高 变化的原因分别是
变化的原因分别是③根据图1、图2分析,为提高CO的选择性(即CO在合成气中的体积分数)可采取的措施是
A.提高
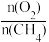 比例 B.降低
比例 B.降低 比例 C.高温、高压 D.低温、低压
比例 C.高温、高压 D.低温、低压
您最近一年使用:0次
解题方法
9 . H2在化学工业中有重要用途,中国科学家在以H2为还原剂清除NO的研究方面取得了显著成果,其相关反应如下:
主反应:2NO(g) +2H2(g) N2(g) +2H2O(g) △H1
N2(g) +2H2O(g) △H1
副反应:2NO(g) +H2(g) N2O(g) +H2O(g)△H2
N2O(g) +H2O(g)△H2
试回答下列问题:
(1)已知相关反应过程中的能量变化如下:
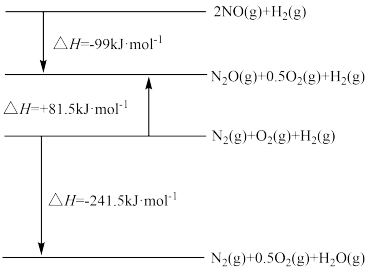
则主反应的△H1=_______ kJ· mol-1,该反应在_______ (填“ 低温”或“高温” )下能自发进行。
(2)研究表明主反应的速率可表示为v=k·c2(NO) ·c(H2)(k为速率常数)。根据Arrhenius方程:lg (R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有
(R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有_______ (填两种)。
(3)在催化剂作用下,将原料气NO、H2按 )=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示:
)=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示:
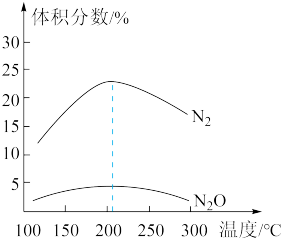
①由图可知,混合气体中N2的体积分数明显高于N2O的原因可能是_______ (填1种);温度高于205°C时,N2的体积分数随温度的升高而减小的原因可能是_______ (列出2点)。
②200°C时,下列事实能说明上述反应达到平衡状态的是_______ (填序号)。
a.混合气体的密度保持不变
b.N2的生成速率等于N2O的消耗速率
c. 保持不变
保持不变
d.H2O(g)的体积分数保持不变
(4)T° C时,向2 L添加催化剂的刚性恒温密闭容器中充入1 mol NO和3 mol H2,发生上述反应,容器内压强随时间的变化如下表(不考虑催化剂对压强的影响):
已知平衡时N2的选择性为90% [N2的选择性= 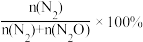 ],则NO的有效去除率 (NO转化为N2)为
],则NO的有效去除率 (NO转化为N2)为_______ % ;根据(2)中的速率方程计算主反应在60 min时的速率v=_______ 。(无需注明单位,用含k的代数式表示)。
主反应:2NO(g) +2H2(g)
 N2(g) +2H2O(g) △H1
N2(g) +2H2O(g) △H1副反应:2NO(g) +H2(g)
 N2O(g) +H2O(g)△H2
N2O(g) +H2O(g)△H2试回答下列问题:
(1)已知相关反应过程中的能量变化如下:

则主反应的△H1=
(2)研究表明主反应的速率可表示为v=k·c2(NO) ·c(H2)(k为速率常数)。根据Arrhenius方程:lg
 (R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有
(R为常数,Ea为反应的活化能),可判断影响速率常数k的外界因素有(3)在催化剂作用下,将原料气NO、H2按
 )=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示:
)=1充入某刚性密闭容器中,在不同温度下,反应相同时间时测得混合气体中N2、N2O的体积分数随温度的变化关系如图所示: 
①由图可知,混合气体中N2的体积分数明显高于N2O的原因可能是
②200°C时,下列事实能说明上述反应达到平衡状态的是
a.混合气体的密度保持不变
b.N2的生成速率等于N2O的消耗速率
c.
 保持不变
保持不变d.H2O(g)的体积分数保持不变
(4)T° C时,向2 L添加催化剂的刚性恒温密闭容器中充入1 mol NO和3 mol H2,发生上述反应,容器内压强随时间的变化如下表(不考虑催化剂对压强的影响):
| 时间/ min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa | p0 | 0.96p0 | 0. 92p0 | 0. 90p0 | 0. 90p0 |
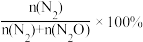 ],则NO的有效去除率 (NO转化为N2)为
],则NO的有效去除率 (NO转化为N2)为
您最近一年使用:0次
解题方法
10 . 二甲醚又称甲醚,是一种十分重要的化工原料,在制药、燃料、农药等化学工业中有许多独特的用途。一定条件下,利用合成气(CO、H2)合成二甲醚,其中主要包括以下三个相互联系的反应:
i.合成气合成甲醇:CO(g) +2H2 (g) CH3OH(g);
CH3OH(g);
ii.甲醇脱水生成二甲醚:2CH3OH(g) CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);
iii.水煤气变换反应:CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
请回答下列问题:
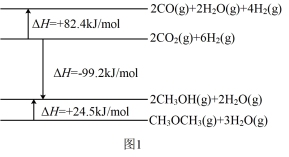
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:_______ 。
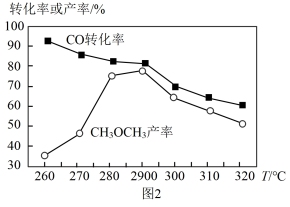
(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是_______ 。
(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
①平衡后,整个过程中CO的转化率为_______ ;v(CH3OCH3)=_______ mol· L-1· h-1。
②反应ii的K=_______ (保留两位小数)。
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为_______ ,假设催化炉产生的CO与H2的物质的量之比为2:1,电极A处产生的CO2有部分参与循环利用,其利用率为_______ 。
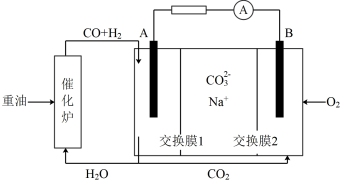
i.合成气合成甲醇:CO(g) +2H2 (g)
 CH3OH(g);
CH3OH(g);ii.甲醇脱水生成二甲醚:2CH3OH(g)
 CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);iii.水煤气变换反应:CO(g)+ H2O(g)
 CO2(g)+ H2(g)。
CO2(g)+ H2(g)。请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:

(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是

(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
| 物质 | H2 | CH3OH | H2O | CO2 |
| 物质的量浓度/(mol·L-1) | l.44 | 0. 78 | 0. 12 | 0.84 |
②反应ii的K=
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为

您最近一年使用:0次



