名校
解题方法
1 . Ⅰ.铁是生产生活、科学研究中的重要物质,研究与Fe相关的反应时要关注反应的快慢和程度,某些有铁参与的反应可设计成原电池。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式_______ 。
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_____ v逆(CO2)(填“>”“<”或“=”)。
(4)0~4min内, CO的平均反应速率v(CO)=____ 。
(5)仅改变下列条件,化学反应速率减小的是___ (填字母)。
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。___ 极(填“正”或“负”),。
(7)写出b电极上的电极反应式______ 。
(1)以下是相同条件下,等体积等浓度的H2O2溶液分解的对比实验时,放出 O2的体积随时间的变化关系示意图(线a为使用FeCl3作催化剂,线b为不使用催化剂),其中正确的图像是______(填字母)。
A. | B. |
C. | D. |
Ⅱ.已知下列热化学为程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
②Fe2O3(s)+CO(g) = 2FeO(s)+CO2(g) △H2=﹣3 kJ·mol-1
(2)写出Fe被CO2氧化成FeO(s) 和 CO的热化学方程式
一定温度下,向某密闭容器中加入足量铁并充入一定量的CO2气体,发生第(2)题的反应。反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
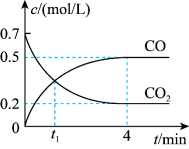
(4)0~4min内, CO的平均反应速率v(CO)=
(5)仅改变下列条件,化学反应速率减小的是
A.减少铁的质量 B.降低温度 C.保持压强不变,充入He使容器的体积增大
Ⅲ.某化学兴趣小组利用反应Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计了如图所示的原电池装置。
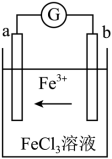
(7)写出b电极上的电极反应式
您最近一年使用:0次
名校
解题方法
2 . 二氧化碳、甲烷等是主要的温室气体。研发二氧化碳和甲烷的利用技术对治理生态环境具有重要意义。
(1)已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=a kJ•mol-1
CO2(g) + H2(g)=CO(g) + H2O(g) ΔH2=b kJ•mol-1
2CO(g)+O2 (g)=2CO2(g) ΔH3=c kJ•mol-1
则催化重整反应CO2(g) + CH4(g) 2CO(g) + 2H2(g)的ΔH4=
2CO(g) + 2H2(g)的ΔH4=___________ 。
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是
___________ 。
A.2v(NH3)=v(CO2) B.密闭容器中c(NH3):c(CO2)=2:1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.密闭容器内压强不变 F.密闭容器中混合气体平均相对分子质量不变
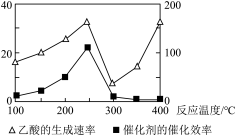
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,250~300℃时,温度升高而乙酸的生成速率降低的原因可能是
___________ 。
(4)饮用水中的NO
 主要来自于NH
主要来自于NH
 。已知在微生物的作用下,NH
。已知在微生物的作用下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO
 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
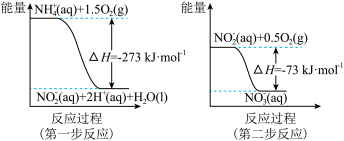
1 mol NH 全部被氧化成NO
全部被氧化成NO 的热化学方程式为
的热化学方程式为___________ 。
(5)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示图中有机废水中有机物可用C6H10O5表示,回答下列问题。
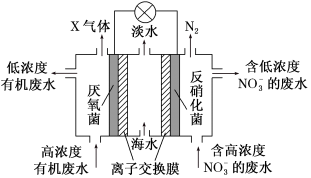
①海水中的Na+由中间室移向___________ (选填“左”或“右”)室。
②该电池负极的电极反应方程式为___________ 。
③电路中每通过1 mol电子,产生标准状况下气体的体积为___________ L。
(1)已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=a kJ•mol-1
CO2(g) + H2(g)=CO(g) + H2O(g) ΔH2=b kJ•mol-1
2CO(g)+O2 (g)=2CO2(g) ΔH3=c kJ•mol-1
则催化重整反应CO2(g) + CH4(g)
 2CO(g) + 2H2(g)的ΔH4=
2CO(g) + 2H2(g)的ΔH4=(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是A.2v(NH3)=v(CO2) B.密闭容器中c(NH3):c(CO2)=2:1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
E.密闭容器内压强不变 F.密闭容器中混合气体平均相对分子质量不变
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,还可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,250~300℃时,温度升高而乙酸的生成速率降低的原因可能是

(4)饮用水中的NO
 主要来自于NH
主要来自于NH 。已知在微生物的作用下,NH
。已知在微生物的作用下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
1 mol NH
 全部被氧化成NO
全部被氧化成NO 的热化学方程式为
的热化学方程式为(5)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示图中有机废水中有机物可用C6H10O5表示,回答下列问题。

①海水中的Na+由中间室移向
②该电池负极的电极反应方程式为
③电路中每通过1 mol电子,产生标准状况下气体的体积为
您最近一年使用:0次
名校
3 . 回答下列问题
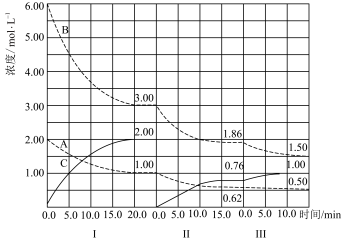
(1)反应aA(g) + bB(g) cC(g) ∆H < 0在恒容条件下进行。改变反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) ∆H < 0在恒容条件下进行。改变反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
①反应的化学方程式中a : b : c为________ 。
②由第一次平衡到第二次平衡,可采取的措施是________ 。
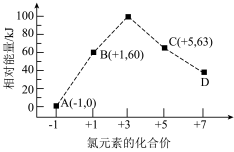
(2)如图表示一定条件下,在水溶液中1 mol Cl-、1 mol ClO (x=1,2,3,4)的能量相对大小。
(x=1,2,3,4)的能量相对大小。
①比较微粒的稳定性:B_________ C(填“>”或“<”)。
②D是____________ (填离子符号)。
③B → A+C反应的热化学方程式为________________ (用离子符号表示)。
(3)在真空恒容密闭容器中加入一定量PH4I固体,T℃ 时发生如下反应: PH4I(s) PH3(g) + HI(g)
PH3(g) + HI(g)
①下列可以作为反应达到平衡状态判断依据的是_________ 。
A.容器内 HI 的气体体积分数不变
B.容器内 PH4I 质量不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
②一定温度下,测得体系总压(p)随时间(t)的变化如下表所示:
试判断580min反应是否达平衡:_____ (填“是”或“否”),理由:______________ 。
(1)反应aA(g) + bB(g)
 cC(g) ∆H < 0在恒容条件下进行。改变反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) ∆H < 0在恒容条件下进行。改变反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:①反应的化学方程式中a : b : c为
②由第一次平衡到第二次平衡,可采取的措施是

(2)如图表示一定条件下,在水溶液中1 mol Cl-、1 mol ClO
 (x=1,2,3,4)的能量相对大小。
(x=1,2,3,4)的能量相对大小。①比较微粒的稳定性:B
②D是
③B → A+C反应的热化学方程式为

(3)在真空恒容密闭容器中加入一定量PH4I固体,T℃ 时发生如下反应: PH4I(s)
 PH3(g) + HI(g)
PH3(g) + HI(g) ①下列可以作为反应达到平衡状态判断依据的是
A.容器内 HI 的气体体积分数不变
B.容器内 PH4I 质量不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
②一定温度下,测得体系总压(p)随时间(t)的变化如下表所示:
| t/min | 0 | 100 | 150 | 250 | 420 | 540 | 580 |
| p/kpa | 0 | 1.2 | 1.8 | 3.0 | 5.04 | 6.48 | 6.90 |
您最近一年使用:0次
名校
解题方法
4 . 工业合成尿素 以
以 和
和 为原料,在合成塔中存在如图转化:
为原料,在合成塔中存在如图转化:

(1)液相中,合成尿素总反应的热化学反应方程式为_______ 。
(2)一定条件下, 的平衡转化率与温度、初始氨碳比
的平衡转化率与温度、初始氨碳比 、水碳比
、水碳比 的关系如图2和图3所示,回答下列问题:
的关系如图2和图3所示,回答下列问题:

下列说法不正确的是_______(填标号)。
(3)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:
 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:
完成下列填空:
①试比较 、
、 的大小,
的大小,
_______  (填写“>”“=”或“<”)。
(填写“>”“=”或“<”)。
②将 和
和 投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是_______ (填标号)。
A.
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
③某合成氨速率方程为 ,其中k为速率常数,根据表中数据,
,其中k为速率常数,根据表中数据,
_______ 。
在合成氨过程中,需要不断分离出氨的原因为_______ (填标号)。
A.有利于平衡正向移动 B.提高正反应速率 C.防止催化剂中毒
 以
以 和
和 为原料,在合成塔中存在如图转化:
为原料,在合成塔中存在如图转化:
(1)液相中,合成尿素总反应的热化学反应方程式为
(2)一定条件下,
 的平衡转化率与温度、初始氨碳比
的平衡转化率与温度、初始氨碳比 、水碳比
、水碳比 的关系如图2和图3所示,回答下列问题:
的关系如图2和图3所示,回答下列问题:
下列说法不正确的是_______(填标号)。
A.图2两曲线中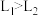 |
| B.增大氨碳比有利于提高尿素产率,过量氨气能与水蒸气作用促进第二步反应正移 |
C.图3曲线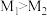 ,增大水碳比有利于尿素生成 ,增大水碳比有利于尿素生成 |
D.实际工业生产时,可选用初始条件为氨碳比 和水碳比 和水碳比 |

 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K |  |  | 0.5 |
①试比较
 、
、 的大小,
的大小,
 (填写“>”“=”或“<”)。
(填写“>”“=”或“<”)。②将
 和
和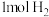 投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是A.

B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
③某合成氨速率方程为
 ,其中k为速率常数,根据表中数据,
,其中k为速率常数,根据表中数据,
| 实验 |  |  |  |  |
| 1 | m | n | p | q |
| 2 | 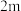 | n | p |  |
| 3 | m | n |  | 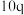 |
| 4 | m |  | P | 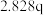 |
A.有利于平衡正向移动 B.提高正反应速率 C.防止催化剂中毒
您最近一年使用:0次
2023-02-12更新
|
383次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
5 . 二氧化碳催化加氢是实现双碳达标的重要方式。
已知:I.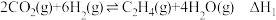
II.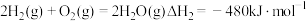
III.
(1)
_______  。
。
(2) 时,向一体积为2L的恒容密闭容器中通入2molCO2(g)和6molH2(g),只发生反应I,测得容器内总压强变化如图。
时,向一体积为2L的恒容密闭容器中通入2molCO2(g)和6molH2(g),只发生反应I,测得容器内总压强变化如图。
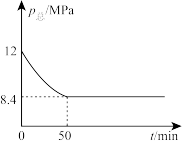
① 内,
内, 的平均速率为
的平均速率为_______ 。
②达到平衡时, 的转化率为
的转化率为_______ 。
③下列措施能提高 平衡转化率的是
平衡转化率的是_______ (填标号)。
A.使用合适的催化剂 B.充入氢气 C.升高温度 D.分离产物
(3)已知反应I的正反应速率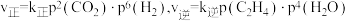 (
(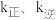 为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。
为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。
①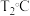 时,
时,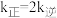 ,则该温度下压强平衡常数
,则该温度下压强平衡常数
_______ 。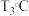 ,平衡时
,平衡时 ,则
,则
_______ (填“>”、“<”或“=”) 。
。
②下列说法正确的是_______ (填标号)。
A.升高温度,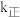 增大的倍数大于
增大的倍数大于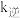 增大的倍数
增大的倍数
B.加入高效催化剂,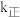 增大的倍数等于
增大的倍数等于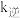 增大的倍数
增大的倍数
C.增大压强,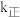 增大的倍数大于
增大的倍数大于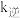 增大的倍数
增大的倍数
D.增大 浓度,
浓度,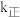 增大的倍数大于
增大的倍数大于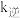 增大的倍数
增大的倍数
(4)工业上采用电催化法实现 还原制乙烯,除乙烯外还有副产物,装置如图所示。
还原制乙烯,除乙烯外还有副产物,装置如图所示。
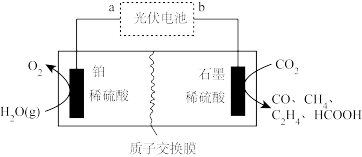
石墨电极上生成乙烯的电极反应式为_______ ;当生成了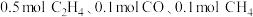 和
和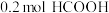 时,理论上有
时,理论上有_______ 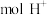 通过质子交换膜。
通过质子交换膜。
已知:I.
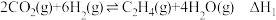
II.
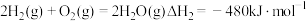
III.

(1)

 。
。(2)
 时,向一体积为2L的恒容密闭容器中通入2molCO2(g)和6molH2(g),只发生反应I,测得容器内总压强变化如图。
时,向一体积为2L的恒容密闭容器中通入2molCO2(g)和6molH2(g),只发生反应I,测得容器内总压强变化如图。
①
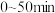 内,
内, 的平均速率为
的平均速率为②达到平衡时,
 的转化率为
的转化率为③下列措施能提高
 平衡转化率的是
平衡转化率的是A.使用合适的催化剂 B.充入氢气 C.升高温度 D.分离产物
(3)已知反应I的正反应速率
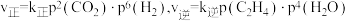 (
(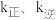 为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。
为正、逆反应速率常数,只与温度、催化剂有关,与浓度无关)。①
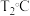 时,
时,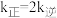 ,则该温度下压强平衡常数
,则该温度下压强平衡常数
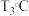 ,平衡时
,平衡时 ,则
,则
 。
。②下列说法正确的是
A.升高温度,
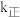 增大的倍数大于
增大的倍数大于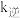 增大的倍数
增大的倍数B.加入高效催化剂,
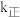 增大的倍数等于
增大的倍数等于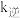 增大的倍数
增大的倍数C.增大压强,
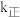 增大的倍数大于
增大的倍数大于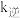 增大的倍数
增大的倍数D.增大
 浓度,
浓度,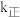 增大的倍数大于
增大的倍数大于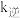 增大的倍数
增大的倍数(4)工业上采用电催化法实现
 还原制乙烯,除乙烯外还有副产物,装置如图所示。
还原制乙烯,除乙烯外还有副产物,装置如图所示。
石墨电极上生成乙烯的电极反应式为
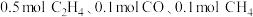 和
和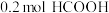 时,理论上有
时,理论上有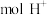 通过质子交换膜。
通过质子交换膜。
您最近一年使用:0次
名校
6 . 煤燃烧产生的SO2是形成酸雨的重要原因之一,工业上可采用多种方法减少SO2的排放。回答下列问题:
(1)H2还原法:
已知:2H2S(g)+SO2(g)=3S(s)+2H2O(1) △H=akJ·mol-1
H2S(g)=H2(g)+S(s) △H=bkJ·mol-1
H2O(l)=H2O(g) △H=ckJ·mol-1
SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式_______ 。
(2)碘循环法:其循环过程如图所示A为_______ (填化学式),在整个循环系统中做催化剂的物质是_______ 。
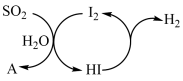
(3)钠碱循环法:1mol/L的Na2SO3溶液作为吸收液来吸收尾气SO2。
①Na2SO3溶液中:c(SO )+c(HSO
)+c(HSO )+c(H2SO3)=
)+c(H2SO3)=_______ mol/L;c(OH-)=c(H+)+c(HSO )+
)+_______ 。
②当溶液的pH约为6时,Na2SO3溶液吸收SO2能力显著下降,此时溶液中c(SO )的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为
)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______ 。
(4)氨石灰水法:
该方法分两步:
第一步:用过量的浓氨水吸收SO2,并在空气中氧化;
第二步:加入澄清石灰水。
已知:Ksp(CaSO4)=8×10-7,Kb(NH3•H2O)=1.25×10-5。
则第二步反应:Ca2+(aq)+2OH-(aq)+2NH (aq)+SO
(aq)+SO (aq)=CaSO4(s)+2NH3•H2O(aq)的平衡常数K=
(aq)=CaSO4(s)+2NH3•H2O(aq)的平衡常数K=_______ 。
(5)已知废气中SO2浓度为8.0g/m3.软锰矿浆(含MnO2)对SO2的吸收率可达90%,则处理100m3燃煤尾气,可得到硫酸锰晶体(MnSO4•H2O相对分子质量为169)的质量为_______ kg(结果保留3位有效数字)。
(1)H2还原法:
已知:2H2S(g)+SO2(g)=3S(s)+2H2O(1) △H=akJ·mol-1
H2S(g)=H2(g)+S(s) △H=bkJ·mol-1
H2O(l)=H2O(g) △H=ckJ·mol-1
SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式
(2)碘循环法:其循环过程如图所示A为

(3)钠碱循环法:1mol/L的Na2SO3溶液作为吸收液来吸收尾气SO2。
①Na2SO3溶液中:c(SO
 )+c(HSO
)+c(HSO )+c(H2SO3)=
)+c(H2SO3)= )+
)+②当溶液的pH约为6时,Na2SO3溶液吸收SO2能力显著下降,此时溶液中c(SO
 )的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为
)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为(4)氨石灰水法:
该方法分两步:
第一步:用过量的浓氨水吸收SO2,并在空气中氧化;
第二步:加入澄清石灰水。
已知:Ksp(CaSO4)=8×10-7,Kb(NH3•H2O)=1.25×10-5。
则第二步反应:Ca2+(aq)+2OH-(aq)+2NH
 (aq)+SO
(aq)+SO (aq)=CaSO4(s)+2NH3•H2O(aq)的平衡常数K=
(aq)=CaSO4(s)+2NH3•H2O(aq)的平衡常数K=(5)已知废气中SO2浓度为8.0g/m3.软锰矿浆(含MnO2)对SO2的吸收率可达90%,则处理100m3燃煤尾气,可得到硫酸锰晶体(MnSO4•H2O相对分子质量为169)的质量为
您最近一年使用:0次
2022-06-11更新
|
106次组卷
|
2卷引用:河北省石家庄市第二十三中学2021-2022学年高一下学期期末考试化学试题
7 . CO2的回收利用对减少温室气体排放,改善人类生存环境具有重要意义。
(1)利用CO2和CH4重整可制合成气(主要成分为CO、H2),重整过程中部分反应的热化学方程式如下:
①CH4(g)═C(s)+2H2(g)△H=+75.0 kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+4l.0 kJ•mol-1
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0 kJ•mol-1
则反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的 △H=___________ 。
(2)CO2可经过催化氢化合成乙烯。反应的化学方程式为: 2CO2(g)+6H2(g) CH2=CH2(g)+aM(g) △H。 在2L密闭容器中充入2 molCO2和n molH2,在一定条件下发生反应,CO2的转化率与温度、投料比X{X=
CH2=CH2(g)+aM(g) △H。 在2L密闭容器中充入2 molCO2和n molH2,在一定条件下发生反应,CO2的转化率与温度、投料比X{X= }的关系如图所示:
}的关系如图所示:
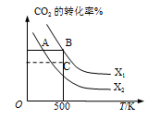
①M的化学式为___________ , a=___________ 。
②A、B两点对应的平衡常数:Ka___________ Kb (填“>”“<”或“=”)
③当X=X2时,C点处V正___________ V逆。(填“>”“<”或“=”)
④合成乙烯的反应能够自发进行的条件是___________ 。
⑤若X=2、T=300K,当反应进行到50 min时,CO2的转化率为25%,则反应速率v(H2)=___________ 。
(1)利用CO2和CH4重整可制合成气(主要成分为CO、H2),重整过程中部分反应的热化学方程式如下:
①CH4(g)═C(s)+2H2(g)△H=+75.0 kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+4l.0 kJ•mol-1
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0 kJ•mol-1
则反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的 △H=
(2)CO2可经过催化氢化合成乙烯。反应的化学方程式为: 2CO2(g)+6H2(g)
 CH2=CH2(g)+aM(g) △H。 在2L密闭容器中充入2 molCO2和n molH2,在一定条件下发生反应,CO2的转化率与温度、投料比X{X=
CH2=CH2(g)+aM(g) △H。 在2L密闭容器中充入2 molCO2和n molH2,在一定条件下发生反应,CO2的转化率与温度、投料比X{X= }的关系如图所示:
}的关系如图所示:
①M的化学式为
②A、B两点对应的平衡常数:Ka
③当X=X2时,C点处V正
④合成乙烯的反应能够自发进行的条件是
⑤若X=2、T=300K,当反应进行到50 min时,CO2的转化率为25%,则反应速率v(H2)=
您最近一年使用:0次
2021-02-09更新
|
233次组卷
|
4卷引用:江西省赣州市赣县第三中学2022-2023学年高一上学期10月月考化学试题
江西省赣州市赣县第三中学2022-2023学年高一上学期10月月考化学试题江西省赣州市2020届高三上学期期末考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练(已下线)学科网2021年高三3月大联考考后强化卷(山东卷)
解题方法
8 . 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(1)汽车发动机工作时会引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=
2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=____ mol/(L·min),N2的平衡转化率为___ ,2000 K时该反应的平衡常数K=___ 。
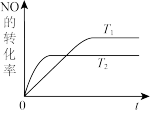
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示。
①反应2NO(g) N2(g)+O2(g)为
N2(g)+O2(g)为____ 反应(填“吸热”或“放热”)。
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是
N2(g)+O2(g)已达到平衡的是____ (填序号)。
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:________ ;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NO)转化为无毒气体,该反应的化学方程式为______ 。
(1)汽车发动机工作时会引起反应:N2(g)+O2(g)
 2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=
2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示。
①反应2NO(g)
 N2(g)+O2(g)为
N2(g)+O2(g)为②一定温度下,能够说明反应2NO(g)
 N2(g)+O2(g)已达到平衡的是
N2(g)+O2(g)已达到平衡的是a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NO)转化为无毒气体,该反应的化学方程式为
您最近一年使用:0次
9 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=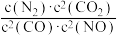 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_______ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=_______ ,该条件下的平衡常数K=_______ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=_______ 。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
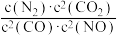 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
您最近一年使用:0次
2018-09-10更新
|
353次组卷
|
6卷引用:广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题
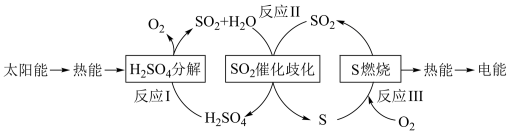
10 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
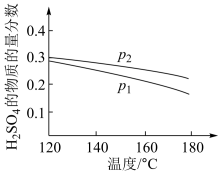
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
2018-06-09更新
|
6536次组卷
|
28卷引用:江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题
江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题福建省福州市第三中学2019-2020学年高三10月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》2020届人教版高三专题基础复习专题7《化学反应速率与化学平衡》测试卷四川省成都市实验中学2019-2020学年高三下学期第三次周测化学试题(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第3节 化学反应的速率北京东城区2019-2020学年高二下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高三上学期期中考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)化学(上海C卷)-学易金卷:2023年高考第一次模拟考试卷北京市第八中学2022-2023学年高二上学期期末考试化学试题北京市第一○一中学2023-2024学年高二上学期统练一化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题10-2023新东方高二上期中考化学



