名校
1 . 增大压强对下列反应的速率无影响的是
| A.CO2(g) + Ca(OH)2(aq)= CaCO3(s)↓+H2O(l) |
B.H2 (g) +I2(g) 2HI(g) 2HI(g) |
| C.NaCl(aq) +AgNO3(aq)=AgCl(s)↓+NaNO3(aq) |
D.N2(g)+3H2(g) 2NH3(g) 2NH3(g) |
您最近一年使用:0次
名校
解题方法
2 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:

(1)电解饱和食盐水的化学方程式为____________ 。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________ (填字母序号)。
a.Na2SO4b.NaNO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为 。
。 可继续被氧化为高碘酸根(
可继续被氧化为高碘酸根(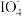 ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:_______________________ 。
②请写出NaIO3被氧化为NaIO4的离子反应方程式为________________________ 。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10min时不同pH体系吸光度不同的原因:__________________ 。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因____________________ 。
③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上至少 需要0.05mol•L-1NaClO溶液_____________ L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)

(1)电解饱和食盐水的化学方程式为
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4b.NaNO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为
 。
。 可继续被氧化为高碘酸根(
可继续被氧化为高碘酸根(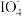 ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:
②请写出NaIO3被氧化为NaIO4的离子反应方程式为
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10min时不同pH体系吸光度不同的原因:
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因
③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上
您最近一年使用:0次
名校
3 . 反应2X(g)+Y(g) 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
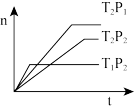
 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |
您最近一年使用:0次
2020-12-02更新
|
177次组卷
|
6卷引用:宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题
名校
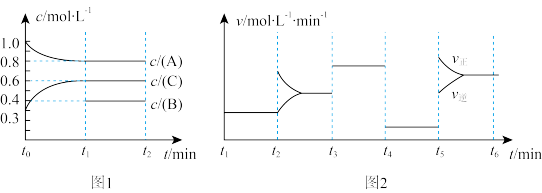
4 . (1)向一体积不变的密闭容器中加入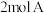 、
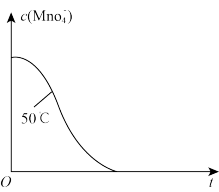
、 和一定量的B三种气体。一定条件下发生反应
和一定量的B三种气体。一定条件下发生反应 ,各物质浓度随时间变化如图1所示。图2为
,各物质浓度随时间变化如图1所示。图2为 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知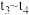 阶段为使用催化剂;图1中
阶段为使用催化剂;图1中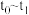 阶段
阶段 未画出。
未画出。
①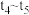 ,
,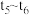 阶段改变的条件为
阶段改变的条件为_________ ,________ B的起始物质的量为________ 。
②为使该反应的反应速率减慢且平衡向逆反应方向移动可以采取的措施有_________ 。
(2)某小组利用 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知: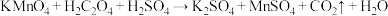 (未配平)。
(未配平)。
①表中
___________ mL,
___________ mL
②探究温度对化学反应速率影响的实验编号是________ (填编号,下同),可探究反应物浓度对反应速率影响的实验编号是____________ 。
③实验①测得 溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率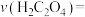
_______________ .
④已知50℃时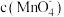 与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时
与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时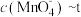 的变化曲线示意图。
的变化曲线示意图。_________
 、
、 和一定量的B三种气体。一定条件下发生反应
和一定量的B三种气体。一定条件下发生反应 ,各物质浓度随时间变化如图1所示。图2为
,各物质浓度随时间变化如图1所示。图2为 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知 阶段为使用催化剂;图1中
阶段为使用催化剂;图1中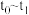 阶段
阶段 未画出。
未画出。①
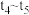 ,
,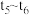 阶段改变的条件为
阶段改变的条件为②为使该反应的反应速率减慢且平衡向逆反应方向移动可以采取的措施有

(2)某小组利用
 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知: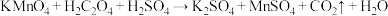 (未配平)。
(未配平)。| 实验编号 | 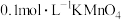 酸性溶液的体积 酸性溶液的体积 | 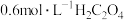 溶液的体积 溶液的体积 |  的体积 的体积 | 实验温度/℃ | 溶液褪色所需时间 |
| ① | 10 |  | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 |  | 50 |


②探究温度对化学反应速率影响的实验编号是
③实验①测得
 溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率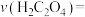
④已知50℃时
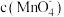 与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时
与反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时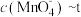 的变化曲线示意图。
的变化曲线示意图。
您最近一年使用:0次
名校
5 .  反应过程中的能量变化如图所示,图中
反应过程中的能量变化如图所示,图中 表示无催化剂时正反应的活化能,
表示无催化剂时正反应的活化能, 表示无催化剂时逆反应的活化能,下列有关叙述不正确的是
表示无催化剂时逆反应的活化能,下列有关叙述不正确的是

 反应过程中的能量变化如图所示,图中
反应过程中的能量变化如图所示,图中 表示无催化剂时正反应的活化能,
表示无催化剂时正反应的活化能, 表示无催化剂时逆反应的活化能,下列有关叙述不正确的是
表示无催化剂时逆反应的活化能,下列有关叙述不正确的是
| A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 |
| B.有气体参加的化学反应,若增大压强即缩小反应容器的体积,可增加活化分子的百分数,从而使反应速率增大 |
| C.该反应中,反应物的总键能小于生成物的总键能 |
D.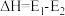 ,使用催化剂改变活化能,但不改变反应热 ,使用催化剂改变活化能,但不改变反应热 |
您最近一年使用:0次
名校
解题方法
6 . 下列说法正确的是
| A.足量盐酸与少量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气的物质的量 |
| B.增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率 |
C.反应3H2(g)+N2(g) 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率可能改变 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率可能改变 |
D.对于反应3KSCN(aq)+ FeCl3(aq) Fe(SCN)3(aq)+ 3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大 Fe(SCN)3(aq)+ 3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大 |
您最近一年使用:0次
2020-11-19更新
|
100次组卷
|
3卷引用:湖北省襄阳市五校(宜城一中、枣阳一中、襄州一中、曾都一中、南漳一中)2020-2021学年高二上学期期中联考化学试题
名校
解题方法
7 . 汽车尾气处理存在反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
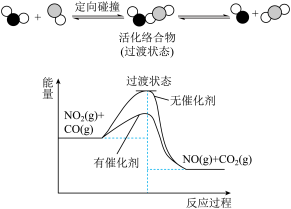
 NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
NO(g)+CO2(g),该反应过程及能量变化如图所示,下列说法正确的是( )
| A.升高温度,平衡正向移动 |
| B.该反应生成了具有非极性共价键的CO2 |
| C.反应物转化为活化络合物需要吸收能量 |
| D.使用催化剂可以有效提高反应物的平衡转化率 |
您最近一年使用:0次
2020-11-14更新
|
252次组卷
|
8卷引用:【区级联考】北京市海淀区2019届高三5月期末练习(二模)理综化学试题
名校
8 . 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
| A.①④ | B.②③ | C.①② | D.③④ |
您最近一年使用:0次
2020-11-11更新
|
499次组卷
|
16卷引用:宁夏石嘴山市第三中学2019-2020学年高二6月月考化学试题
宁夏石嘴山市第三中学2019-2020学年高二6月月考化学试题青海省西宁市第四高级中学2017-2018学年高二上学期第二次月考化学试题(已下线)2018年9月13日 《每日一题》人教选修4-影响化学平衡移动的因素(一)【全国百强校】黑龙江省大庆实验中学2018-2019学年高二上学期10月月考化学试题河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题内蒙古翁牛特旗乌丹第二中学2019-2020学年高二上学期期中考试化学试题(已下线)2.3.2 压强变化对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)广东省惠州市惠东中学2020-2021学年高二上学期期中考试化学试题辽宁省沈阳市郊联体2020-2021学年高二上学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题辽宁省辽河油田第一高级中学2021-2022学年高二上学期月考化学试题(A部)第二节 化学平衡 第3课时 影响化学平衡的因素(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素
名校
9 . 在恒容条件下,能使NO2(g)+CO(g) CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:
 CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:| A.增大NO2或CO的浓度 |
| B.减小CO2或NO的浓度 |
| C.通入Ne使气体的压强增大 |
| D.升高反应的温度 |
您最近一年使用:0次
2020-11-02更新
|
643次组卷
|
22卷引用:2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷
2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷2016-2017学年山西省怀仁一中高二上开学考化学试卷2016-2017学年湖北沙市中学高二上第一次双周练化学卷2016-2017学年江苏省泰州中学高二上月考一化学试卷安徽师范大学附属中学2017-2018学年高二上学期期中考查化学试题山东省师范大学附属中学2017-2018学年高二上学期第五次学分认定(期中)考试(理)化学试题山东师范大学附属中学2017-2018学年高二上学期第五次学分认定考试化学(理)试题【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题【校级联考】天津市静海区2019届高三上学期12月四校联考化学试题福建省漳州市长泰县第一中学2019-2020学年高二10月月考化学试题重庆市第一中学2020-2021学年高二10月月考化学试题(已下线)第10单元 化学反应速率与化学平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题重庆市清华中学2020-2021学年高二11月月考化学试题宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题河南省新乡县龙泉高级中学2021-2022学年高二上学期9月月考化学试题广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题上海市上海中学2022-2023学年高一下学期期末考试化学试题四川省南充高级中学2021-2022学年高一下学期第二次月考化学试题广东省汕头市潮阳黄图盛中学2023-2024学年高二上学期期中考试化学试题
10 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图:
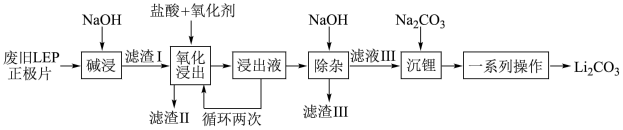
已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是_______ (填标号)。
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是______ 。在“氧化浸出”时,温度不宜超过50℃,其目的是________ 。“氧化浸出”时生成了难溶的FePO4,该反应的离子方程式为_________ 。
(3)“浸出液”循环两次的目的是________ 。
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为________ 。“一系列操作”具体包括______ 、洗涤、干燥。
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为_________ 。

已知:Li2CO3在水中的溶解度随温度升高而降低,但煮沸时发生水解。回答下列问题:
(1)在“碱浸”时,为加快浸出速率,下列措施不可行的是
a.适当提高浸出温度
b.使用电动搅拌器
c.适当提高氢氧化钠的浓度
d.增大废料的颗粒
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如表,实际生产中氧化剂选用H2O2,不选用 NaClO3的原因是
| 序号 | 锂含量/% | 氧化剂 | pH | 浸出液体Li浓度/(g·L-1) | 浸出渣中Li含量/% |
| 1 | 3.7 | H2O2 | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 | NaClO3 | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 | O2 | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 | NaClO | 3.5 | 8.24 | 0.43 |
(4)“沉锂”的温度保持在95℃,最适宜的加热方式为
(5)“滤渣Ⅱ”经纯化可得FePO4,流程中生成的Li2CO3、FePO4在高温条件下与H2C2O4煅烧可得 LiFePO4,实现再生利用,其化学方程式为
您最近一年使用:0次
2020-11-02更新
|
509次组卷
|
3卷引用:宁夏银川一中2021届高三第三次月考理综化学试题



