名校
1 . 无催化剂作用下,以乙二醛和 为原料制取乙醛酸的可能反应历程如图所承,TS表承过渡态,IM表示中间体。下列说法错误的是
为原料制取乙醛酸的可能反应历程如图所承,TS表承过渡态,IM表示中间体。下列说法错误的是
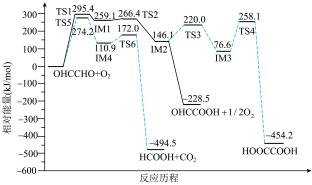
 为原料制取乙醛酸的可能反应历程如图所承,TS表承过渡态,IM表示中间体。下列说法错误的是
为原料制取乙醛酸的可能反应历程如图所承,TS表承过渡态,IM表示中间体。下列说法错误的是
A.乙二醛被 氧化可得3种有机产物 氧化可得3种有机产物 |
| B.反应很短一段时间内,IM4多于IM1 |
| C.乙二醛制乙二酸的最大能垒为181.5kJ/mol |
| D.选择合适的催化剂可提高乙醛酸的选择性 |
您最近一年使用:0次
2023-11-19更新
|
350次组卷
|
3卷引用:题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建
(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建湖北省高中名校联盟2024届高三上学期第二次联合测评化学试题新疆石河子第一中学2023-2024学年高三上学期11月月考化学试题
名校
2 . 某溴丁烷与乙醇反应的能量转化如图(“ ”表示过渡态)。下列说法错误的是
”表示过渡态)。下列说法错误的是

 ”表示过渡态)。下列说法错误的是
”表示过渡态)。下列说法错误的是
| A.总反应为取代反应 |
| B.该反应过程中C原子杂化方式有变化 |
| C.反应过程中(CH3)3C+是中间产物 |
| D.决定该过程正反应快慢的步骤与逆反应快慢的步骤互为可逆反应 |
您最近一年使用:0次
解题方法
3 . 催化剂I和II均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法错误的是
P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法错误的是
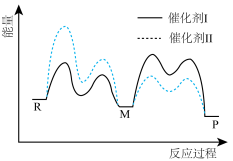
 P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法错误的是
P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法错误的是
| A.使用I和II,均有4个基元反应 |
| B.使用催化剂I时,第三个基元反应是决速反应 |
| C.使用II时,反应体系更快达到平衡 |
| D.使用I时,反应过程中M所能达到的最高浓度更大 |
您最近一年使用:0次
2023-11-12更新
|
215次组卷
|
2卷引用:湖北省武汉市部分重点中学2023-2024学年高二上学期期中联考化学试题
名校
解题方法
4 . 山东大学材料科学与工程学院开发催化剂用于光热催化 加氢制
加氢制 。反应历程如图所示(*表示吸附在催化剂表面)。下列叙述错误的是
。反应历程如图所示(*表示吸附在催化剂表面)。下列叙述错误的是
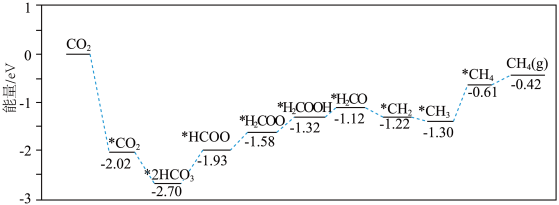
 加氢制
加氢制 。反应历程如图所示(*表示吸附在催化剂表面)。下列叙述错误的是
。反应历程如图所示(*表示吸附在催化剂表面)。下列叙述错误的是
A.催化剂表面上 脱附需吸收能量 脱附需吸收能量 |
B.该历程中的最小能垒(活化能)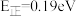 |
C.该历程中决速步骤为 |
| D.工业生产中将催化剂处理成纳米级颗粒更利于提高反应速率 |
您最近一年使用:0次
名校
5 . 已知HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.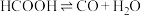

Ⅱ.

T温度下,在密封石英管内完全充满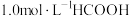 水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列有关说法
水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列有关说法不正确 的是

Ⅰ.
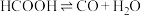

Ⅱ.


T温度下,在密封石英管内完全充满
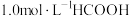 水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列有关说法
水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。下列有关说法
A.混合体系达平衡后: |
| B.活化能:反应Ⅰ<反应Ⅱ |
C. 浓度变小的原因是 浓度变小的原因是 的生成导致反应Ⅰ平衡逆向移动 的生成导致反应Ⅰ平衡逆向移动 |
D. 可降为0 可降为0 |
您最近一年使用:0次
2023-11-10更新
|
888次组卷
|
5卷引用:内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题
内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题(已下线)热点18 电解质溶液图像分析(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)浙江省温州市普通高中2024届高三上学期第一次适应性考试(一模)化学试题(已下线)专题05 化学反应与能量(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
6 . 一定条件下N2(g)、O2(g)反应生成NO(g)的能量关系如图所示,下列说法错误的是
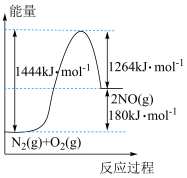

A.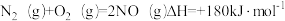 |
| B.该反应中反应物分子的每次碰撞都为有效碰撞 |
| C.正反应的活化能大于逆反应的活化能 |
| D.使用催化剂可增加单位时间内NO的产量 |
您最近一年使用:0次
2023-11-06更新
|
229次组卷
|
3卷引用:【定心卷】2.1.3 活化能随堂练习-人教版2023-2024学年选择性必修1
解题方法
7 . 纳米碗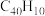 是一种奇特的碗状共轭体系。高温条件下,
是一种奇特的碗状共轭体系。高温条件下,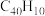 可以由
可以由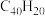 分子经过连续5步氢抽提和闭环脱氢反应生成。某过程的反应机理和能量变化如下:
分子经过连续5步氢抽提和闭环脱氢反应生成。某过程的反应机理和能量变化如下:
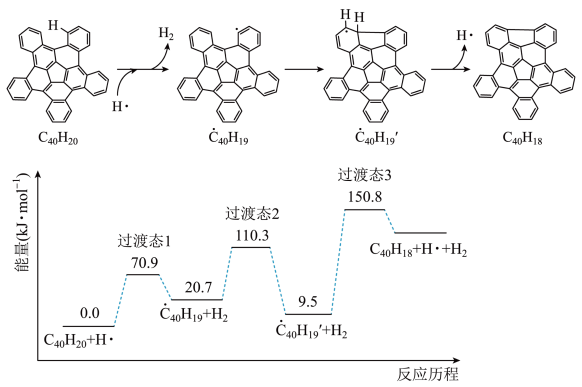
下列说法错误的是
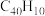 是一种奇特的碗状共轭体系。高温条件下,
是一种奇特的碗状共轭体系。高温条件下,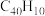 可以由
可以由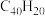 分子经过连续5步氢抽提和闭环脱氢反应生成。某过程的反应机理和能量变化如下:
分子经过连续5步氢抽提和闭环脱氢反应生成。某过程的反应机理和能量变化如下:
下列说法错误的是
A.该历程的总反应方程式为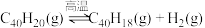 |
| B.图示历程中的基元反应,速率最慢的是第3步 |
C.从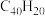 的结构分析, 的结构分析,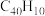 纳米碗中五元环和六元环结构的数目分别为6、10 纳米碗中五元环和六元环结构的数目分别为6、10 |
| D.反应过程中有极性键的断裂和形成 |
您最近一年使用:0次
2023-11-06更新
|
384次组卷
|
4卷引用:题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建
(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建河南省三门峡市2023-2024学年高二上学期1月期末考试化学试题(已下线)T10-化学反应与能量变化湖南省湘东九校2024届高三上学期11月联考化学试题
8 . 苯和液溴反应进程中的能量变化如图所示。
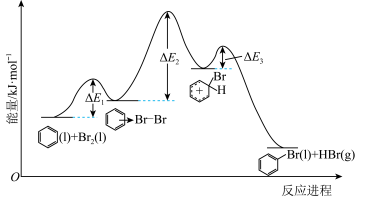
已知:①断裂化学键所需要的能量(kJ/mol):
②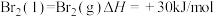
③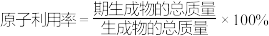
下列叙述正确的是

已知:①断裂化学键所需要的能量(kJ/mol):
| C−H | C−Br | Br−Br(g) | H−Br(g) |
| 413 | 276 | 194 | 366 |
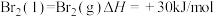
③
下列叙述正确的是
| A.该反应为放热反应,ΔH=-55 kJ/mol |
| B.第一步是该反应的决速步骤 |
| C.该反应的原子利用率约为 88% |
| D.可用NaOH溶液除去溴苯中混有的Br2 |
您最近一年使用:0次
名校
解题方法
9 . 电喷雾电离等方法得到的M+(Fe+、Co+或Ni+等)匀O3反应可得MO+在一定条件下,MO++CH4=M++CH3OH,直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。MO+与CH4或CT4体系的能量随反应进程的变化如图所示,下列说法错误的是
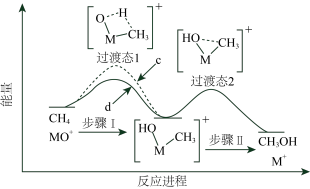

| A.该反应是放热反应 |
| B.步骤Ⅰ和步骤Ⅱ中氢原子的成键方式均发生了变化 |
| C.MO+与CT4反应的能量变化为曲线c |
| D.相同情况下,MO+与CHT3反应,氚代甲醇CT3OH的产量大于CHT2OT |
您最近一年使用:0次
2023-10-28更新
|
471次组卷
|
3卷引用:重庆市第八中学校2023-2024学年高三上学期10月期中考试化学试题
重庆市第八中学校2023-2024学年高三上学期10月期中考试化学试题(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建上海市青浦高中2023-2024学年高二上学期期末考试化学模拟试卷
名校
10 . 某温度下,向恒容密闭容器中充入等物质的量浓度的X(g)和Y(g),同时发生以下两个反应:①X(g)+Y(g) Z(g)+W(g),②X(g)+Y(g)
Z(g)+W(g),②X(g)+Y(g) Z(g)+M(g)。反应①的速率可表示为v1=k1c2(X),反应②的速率可表示为v2=k2c2(X)(k1、k2为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法错误的是
Z(g)+M(g)。反应①的速率可表示为v1=k1c2(X),反应②的速率可表示为v2=k2c2(X)(k1、k2为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法错误的是
 Z(g)+W(g),②X(g)+Y(g)
Z(g)+W(g),②X(g)+Y(g) Z(g)+M(g)。反应①的速率可表示为v1=k1c2(X),反应②的速率可表示为v2=k2c2(X)(k1、k2为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法错误的是
Z(g)+M(g)。反应①的速率可表示为v1=k1c2(X),反应②的速率可表示为v2=k2c2(X)(k1、k2为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法错误的是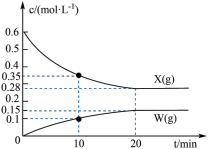
| A.0~10min,Y(g)的平均反应速率为0.025mol•L-1•min-1 |
| B.体系中W和M的浓度之比保持不变,说明反应已平衡 |
C.平衡时,反应②的平衡常数K= |
| D.反应①的活化能比反应②的活化能更大 |
您最近一年使用:0次
2023-10-27更新
|
991次组卷
|
8卷引用:广西南宁市2024届高三上学期毕业班摸底测试化学试题
广西南宁市2024届高三上学期毕业班摸底测试化学试题(已下线)热点13 化学反应速率与化学平衡(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)选择题11-142024届江西省南昌市第十九中学高三下学期模拟预测化学试题(已下线)湖南省永州市道县第一中学2023-2024学年高三下学期5月期中考试化学试题广西部分高中2024届高三第一次摸底测试化学试题(已下线)选择题11-14



