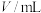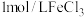1 . 基于非金属原子嵌入石墨烯三嗪基 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“ ”标注,下列说法中错误的是
”标注,下列说法中错误的是
 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“ ”标注,下列说法中错误的是
”标注,下列说法中错误的是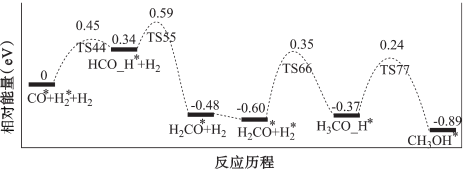
| A.整个反应历程中有四个基元反应 |
B.过渡态相对能量: |
| C.物种吸附在催化剂表面的过程为吸热过程 |
| D.反应决速步的活化能为0.95eV |
您最近一年使用:0次
解题方法
2 . 碳酸二甲酯(DMC)是一种绿色化学品,具有优良的化学反应性能和广泛的应用前景。回答下列问题:
(1)工业上可采用CO低压气相法合成DMC。已知下列反应的热化学方程式:
①2NO(g)+ O2(g)
O2(g) N2O3(g) K1 △H1=akJ/mol
N2O3(g) K1 △H1=akJ/mol
②2CH3OH(g)+N2O3(g) 2CH3ONO(g)+H2O(g) K2 △H2=bkJ/mol
2CH3ONO(g)+H2O(g) K2 △H2=bkJ/mol
③CO(g)+2CH3ONO(g) (CH3O)2CO(g)+2NO(g) K3 △H=ckJ/mol
(CH3O)2CO(g)+2NO(g) K3 △H=ckJ/mol
合成反应2CH3OH(g)+CO(g)+ O2(g)
O2(g) (CH3O)2CO(g)+H2O(g)的△H=
(CH3O)2CO(g)+H2O(g)的△H=_______ kJ/mol,其平衡常数K=_______ (用K1、K2、K3表示)。
(2)甲醇气相氧化羰基化法合成DMC的总反应为:2CH3OH(g)+CO(g)+ O2(g)
O2(g)  (CH3O)2CO(g)+H2O(g)。在3.2MPa下,将物质的量之比为4∶2∶1的反应物CH3OH、CO、O2混合,按一定流速通过装有催化剂的容器,测得甲醇的转化率、DMC的产率受温度影响的曲线如图所示(该工艺的副产物主要是二甲醚和甲酸甲酯):
(CH3O)2CO(g)+H2O(g)。在3.2MPa下,将物质的量之比为4∶2∶1的反应物CH3OH、CO、O2混合,按一定流速通过装有催化剂的容器,测得甲醇的转化率、DMC的产率受温度影响的曲线如图所示(该工艺的副产物主要是二甲醚和甲酸甲酯):______ 。
②结合上图判断,下列有关该反应的说法正确的是___ (填标号)。
a.压强增大平衡正向移动 b.平衡常数随温度升高而增大
c.温度升高平衡正向移动 d.110~130℃之间,随温度升高副反应增多
③在一定条件下,物质的量之比为4:2:1的反应物CH3OH、CO、O2充分反应达到平衡后,甲醇的转化率为24%,生成DMC的选择性为90%。假设副产物只有二甲醚(2CH3OH→CH3OCH3+H2O),则平衡混合气中DMC与H2O的物质的量之比为_______ ,DMC的体积分数是________ (保留两位有效数字)。
(3)研究表明,在碱式氯化铜催化剂表面上,甲醇氧化羰基化反应的机理为:
(CH3OH)※→CH3O…H…Cl+* ①
CH3O…H…Cl+*→CH3O*+HCl ②
CH3O*+CO→CH3OCO* ③
CH3O*+CH3OCO*→CH3OCOOCH3+** ④
……
※、*代表催化剂活性中心,且*为※失去Cl的活性中心;CH3O*代表活化状态。上述四步反应中第②步速率最小,说明该反应的活化能______ (填“最大”或“最小”),其原因是_________ 。
(1)工业上可采用CO低压气相法合成DMC。已知下列反应的热化学方程式:
①2NO(g)+
 O2(g)
O2(g) N2O3(g) K1 △H1=akJ/mol
N2O3(g) K1 △H1=akJ/mol②2CH3OH(g)+N2O3(g)
 2CH3ONO(g)+H2O(g) K2 △H2=bkJ/mol
2CH3ONO(g)+H2O(g) K2 △H2=bkJ/mol③CO(g)+2CH3ONO(g)
 (CH3O)2CO(g)+2NO(g) K3 △H=ckJ/mol
(CH3O)2CO(g)+2NO(g) K3 △H=ckJ/mol合成反应2CH3OH(g)+CO(g)+
 O2(g)
O2(g) (CH3O)2CO(g)+H2O(g)的△H=
(CH3O)2CO(g)+H2O(g)的△H=(2)甲醇气相氧化羰基化法合成DMC的总反应为:2CH3OH(g)+CO(g)+
 O2(g)
O2(g)  (CH3O)2CO(g)+H2O(g)。在3.2MPa下,将物质的量之比为4∶2∶1的反应物CH3OH、CO、O2混合,按一定流速通过装有催化剂的容器,测得甲醇的转化率、DMC的产率受温度影响的曲线如图所示(该工艺的副产物主要是二甲醚和甲酸甲酯):
(CH3O)2CO(g)+H2O(g)。在3.2MPa下,将物质的量之比为4∶2∶1的反应物CH3OH、CO、O2混合,按一定流速通过装有催化剂的容器,测得甲醇的转化率、DMC的产率受温度影响的曲线如图所示(该工艺的副产物主要是二甲醚和甲酸甲酯):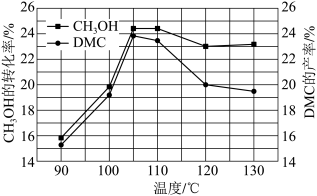
②结合上图判断,下列有关该反应的说法正确的是
a.压强增大平衡正向移动 b.平衡常数随温度升高而增大
c.温度升高平衡正向移动 d.110~130℃之间,随温度升高副反应增多
③在一定条件下,物质的量之比为4:2:1的反应物CH3OH、CO、O2充分反应达到平衡后,甲醇的转化率为24%,生成DMC的选择性为90%。假设副产物只有二甲醚(2CH3OH→CH3OCH3+H2O),则平衡混合气中DMC与H2O的物质的量之比为
(3)研究表明,在碱式氯化铜催化剂表面上,甲醇氧化羰基化反应的机理为:
(CH3OH)※→CH3O…H…Cl+* ①
CH3O…H…Cl+*→CH3O*+HCl ②
CH3O*+CO→CH3OCO* ③
CH3O*+CH3OCO*→CH3OCOOCH3+** ④
……
※、*代表催化剂活性中心,且*为※失去Cl的活性中心;CH3O*代表活化状态。上述四步反应中第②步速率最小,说明该反应的活化能
您最近一年使用:0次
2024-03-12更新
|
48次组卷
|
3卷引用:陕西省安康市高新中学2023-2024学年高三12月月考理科综合试题
陕西省安康市高新中学2023-2024学年高三12月月考理科综合试题陕西省安康市高新中学2023-2024学年高三上学期12月月考理科综合试题(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
3 . 某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图所示,下列说法正确的是
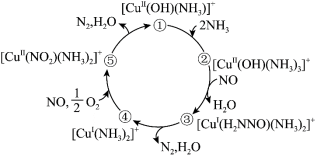

| A.[CuII(OH)(NH3)]+可降低该反应的活化能 |
| B.状态②到状态③的过程中N元素被还原 |
| C.状态③到状态④的过程中有O-H键的断裂 |
D.该脱硝过程的总反应方程式为 |
您最近一年使用:0次
解题方法
4 . 向2L恒容密闭容器中同时加入2
 和6
和6
 ,在催化剂作用下,发生反应:
,在催化剂作用下,发生反应:
ⅰ.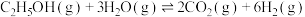

ⅱ.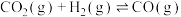

 。
。
平衡时 和
和 的选择性[CO的选择性
的选择性[CO的选择性 ]及
]及 的产率随温度的变化如图所示。下列说法错误的是
的产率随温度的变化如图所示。下列说法错误的是

 和6
和6
 ,在催化剂作用下,发生反应:
,在催化剂作用下,发生反应:ⅰ.
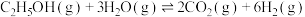

ⅱ.
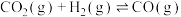

 。
。平衡时
 和
和 的选择性[CO的选择性
的选择性[CO的选择性 ]及
]及 的产率随温度的变化如图所示。下列说法错误的是
的产率随温度的变化如图所示。下列说法错误的是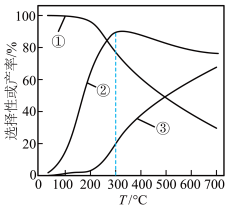
A.某温度下平衡后,向该容器中再加入1 乙醇,乙醇的平衡转化率会减小 乙醇,乙醇的平衡转化率会减小 |
| B.即使采用更高效的催化剂,反应ⅰ的正、逆反应的活化能之差也不变 |
| C.300℃之后以反应ⅰ为主 |
D.乙醇的平衡转化率为80%、 的选择性为60%时, 的选择性为60%时,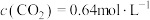 |
您最近一年使用:0次
名校
5 . 某次研究性学习活动中,实验小组用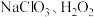 和稀硫酸制备
和稀硫酸制备 ,反应较慢。若反应开始时加入少量盐酸,
,反应较慢。若反应开始时加入少量盐酸, 的生成速率大大提高,且不含
的生成速率大大提高,且不含 ,可能的反应历程示意图如下。
,可能的反应历程示意图如下。

下列有关分析或评价不正确的是
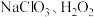 和稀硫酸制备
和稀硫酸制备 ,反应较慢。若反应开始时加入少量盐酸,
,反应较慢。若反应开始时加入少量盐酸, 的生成速率大大提高,且不含
的生成速率大大提高,且不含 ,可能的反应历程示意图如下。
,可能的反应历程示意图如下。
下列有关分析或评价不正确的是
| A.a等于37 | B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C. 为总反应的催化剂 为总反应的催化剂 | D.活化能:反应I大于反应II |
您最近一年使用:0次
2024-01-29更新
|
380次组卷
|
3卷引用: 河南省洛阳市孟津区第一高级中学2023-2024学年高三上学期12月月考化学试题
河南省洛阳市孟津区第一高级中学2023-2024学年高三上学期12月月考化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河南省新乡市第一中学2023-2024学年高三上学期12月月考化学试题
2024·江苏连云港·一模
6 . 氮氧化物( 、
、 等)的处理和资源化利用具有重要意义。
等)的处理和资源化利用具有重要意义。
(1) 的处理。研究证明:
的处理。研究证明: 能提高
能提高 的分解速率,
的分解速率, 参与了第Ⅱ步、第Ⅲ步反应。反应历程(
参与了第Ⅱ步、第Ⅲ步反应。反应历程( 为反应活化能):
为反应活化能):
第Ⅰ步:
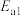
第Ⅱ步:……
第Ⅲ步: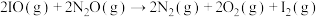
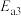
①第Ⅱ步发生反应的方程式为___________ 。
②总反应的反应速率取决于第Ⅱ步,则
___________ 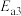 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 的应用。
的应用。 分解
分解 制取
制取 和
和 的原理如下:
的原理如下:
反应Ⅰ:

反应Ⅱ: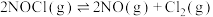

反应的 (
( 值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。

①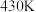 时,反应
时,反应 的
的 为
为___________ 。
② 时,向容积不变的容器中充入
时,向容积不变的容器中充入 和
和 进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在
进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在 时间段内,容器中压强增大的主要原因是
时间段内,容器中压强增大的主要原因是___________ 。

(3)催化电解 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(
,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率( )随电解电压的变化如图-4所示。已知
)随电解电压的变化如图-4所示。已知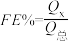 ,
,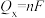 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;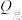 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
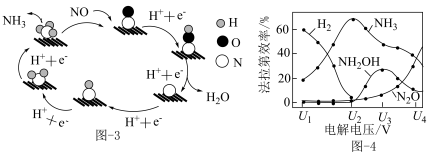
①当电解电压为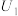 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
②当电解电压为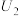 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为___________ 。
③电解电压大于 后,随着电解电压的不断增大,
后,随着电解电压的不断增大, 的法拉第效率迅速增大,可能原因是
的法拉第效率迅速增大,可能原因是___________ (吸附在催化剂上的物种加“*”表示,如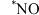 、
、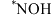 等)。
等)。
 、
、 等)的处理和资源化利用具有重要意义。
等)的处理和资源化利用具有重要意义。(1)
 的处理。研究证明:
的处理。研究证明: 能提高
能提高 的分解速率,
的分解速率, 参与了第Ⅱ步、第Ⅲ步反应。反应历程(
参与了第Ⅱ步、第Ⅲ步反应。反应历程( 为反应活化能):
为反应活化能):第Ⅰ步:

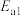
第Ⅱ步:……

第Ⅲ步:
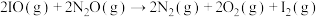
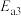
①第Ⅱ步发生反应的方程式为
②总反应的反应速率取决于第Ⅱ步,则

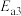 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 的应用。
的应用。 分解
分解 制取
制取 和
和 的原理如下:
的原理如下:反应Ⅰ:


反应Ⅱ:
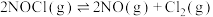

反应的
 (
( 值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
值为平衡时用各气体的分压表示得出的值)的关系如图-1所示。
①
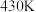 时,反应
时,反应 的
的 为
为②
 时,向容积不变的容器中充入
时,向容积不变的容器中充入 和
和 进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在
进行反应,测得反应过程中容器内压强与时间的关系如图-2所示(反应开始和平衡后容器的温度相同)。在 时间段内,容器中压强增大的主要原因是
时间段内,容器中压强增大的主要原因是
(3)催化电解
 吸收液可将
吸收液可将 还原为
还原为 ,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(
,其催化机理如图-3所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率( )随电解电压的变化如图-4所示。已知
)随电解电压的变化如图-4所示。已知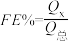 ,
,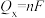 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数;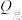 表示电解过程中通过的总电量。
表示电解过程中通过的总电量。
①当电解电压为
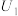 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为②当电解电压为
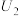 时,催化电解
时,催化电解 生成
生成 的电极反应式为
的电极反应式为③电解电压大于
 后,随着电解电压的不断增大,
后,随着电解电压的不断增大, 的法拉第效率迅速增大,可能原因是
的法拉第效率迅速增大,可能原因是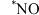 、
、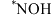 等)。
等)。
您最近一年使用:0次
名校
解题方法
7 . 某化学兴趣小组探究 溶液与
溶液与 的反应历程。
的反应历程。
Ⅰ.药品制备。
(1)实验室制备 的装置如图,仪器a中的试剂是
的装置如图,仪器a中的试剂是__________ 。 溶液的方法是
溶液的方法是__________ 。
Ⅱ.探究 溶液与
溶液与 的反应
的反应
(3)兴趣小组预测, 能使
能使 溶液由黄色变为浅绿色,反应的离子方程式为
溶液由黄色变为浅绿色,反应的离子方程式为__________ 。
向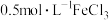 溶液中通入
溶液中通入 至饱和后,用橡皮塞封闭试管,观察到溶液由黄色迅速变为血红色,静置
至饱和后,用橡皮塞封闭试管,观察到溶液由黄色迅速变为血红色,静置 后变回黄色,静置
后变回黄色,静置 后,变为浅绿色。
后,变为浅绿色。
查阅资料:血红色物质可能与 饱和溶液中的主要微粒:
饱和溶液中的主要微粒: 、
、 、
、 、
、 、
、 有关。
有关。
①取少量上述血红色溶液,立即滴加几滴 溶液A,溶液又褪为黄色。据此推测:红色物质的产生与
溶液A,溶液又褪为黄色。据此推测:红色物质的产生与 无关。物质A的化学式为
无关。物质A的化学式为__________ 。
②向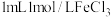 溶液中滴加
溶液中滴加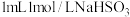 溶液,溶液变为血红色,滴加几滴
溶液,溶液变为血红色,滴加几滴 溶液A,褪成黄色。据此推测:红色物质的产生与
溶液A,褪成黄色。据此推测:红色物质的产生与 和
和 无关,主要与
无关,主要与 或
或 有关。
有关。
③利用分光光度仪测定红色物质的浓度(吸光度越高,浓度越大),实验数据如下:
结论:溶液变血红色的主要原因是 和
和__________ 发生配合反应。
(5)由以上探究结果说明该条件下, 与
与 溶液反应的活化能:配合反应
溶液反应的活化能:配合反应__________ (填“大于”“小于”“等于”)氧化还原反应。
(6)兴趣小组在某次实验中,通入 后未封闭试管,发现血红色更快变回黄色。其可能原因是
后未封闭试管,发现血红色更快变回黄色。其可能原因是__________ (用离子方程式表示)。
 溶液与
溶液与 的反应历程。
的反应历程。Ⅰ.药品制备。
(1)实验室制备
 的装置如图,仪器a中的试剂是
的装置如图,仪器a中的试剂是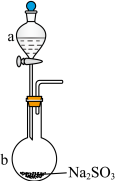
 溶液的方法是
溶液的方法是Ⅱ.探究
 溶液与
溶液与 的反应
的反应(3)兴趣小组预测,
 能使
能使 溶液由黄色变为浅绿色,反应的离子方程式为
溶液由黄色变为浅绿色,反应的离子方程式为向
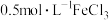 溶液中通入
溶液中通入 至饱和后,用橡皮塞封闭试管,观察到溶液由黄色迅速变为血红色,静置
至饱和后,用橡皮塞封闭试管,观察到溶液由黄色迅速变为血红色,静置 后变回黄色,静置
后变回黄色,静置 后,变为浅绿色。
后,变为浅绿色。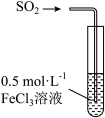
查阅资料:血红色物质可能与
 饱和溶液中的主要微粒:
饱和溶液中的主要微粒: 、
、 、
、 、
、 、
、 有关。
有关。①取少量上述血红色溶液,立即滴加几滴
 溶液A,溶液又褪为黄色。据此推测:红色物质的产生与
溶液A,溶液又褪为黄色。据此推测:红色物质的产生与 无关。物质A的化学式为
无关。物质A的化学式为②向
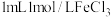 溶液中滴加
溶液中滴加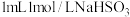 溶液,溶液变为血红色,滴加几滴
溶液,溶液变为血红色,滴加几滴 溶液A,褪成黄色。据此推测:红色物质的产生与
溶液A,褪成黄色。据此推测:红色物质的产生与 和
和 无关,主要与
无关,主要与 或
或 有关。
有关。③利用分光光度仪测定红色物质的浓度(吸光度越高,浓度越大),实验数据如下:
| 吸光度 | ||
|
|
| |
0.5 | 4.0 | 0.0 | 0.412 |
0.5 | 3.6 | 0.4 | 0.359 |
0.5 | 3.2 | 0.8 | 0.331 |
0.5 | 2.8 | 1.2 | 0.297 |
 和
和(5)由以上探究结果说明该条件下,
 与
与 溶液反应的活化能:配合反应
溶液反应的活化能:配合反应(6)兴趣小组在某次实验中,通入
 后未封闭试管,发现血红色更快变回黄色。其可能原因是
后未封闭试管,发现血红色更快变回黄色。其可能原因是
您最近一年使用:0次
名校
解题方法
8 . 基于非金属原子嵌入石墨烯三嗪基 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“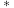 ”标注,下列说法中错误的是
”标注,下列说法中错误的是
 中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“
中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“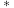 ”标注,下列说法中错误的是
”标注,下列说法中错误的是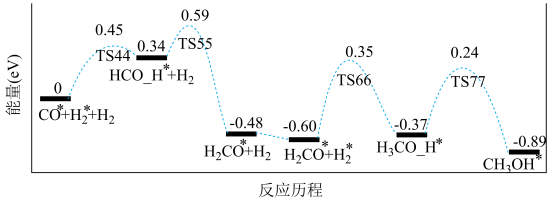
| A.整个反应历程中有极性键的断裂和生成 | B.过渡态相对能量:TS55>TS44>TS77 |
| C.物种吸附在催化剂表面的过程为吸热过程 | D.反应决速步的活化能为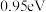 |
您最近一年使用:0次
2024-01-13更新
|
976次组卷
|
5卷引用:辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题
辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题河北省石家庄市河北正定中学2023-2024学年高三下学期4月模拟考试化学试题
9 . 过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论, 的反应历程如下,下列有关说法正确的是
的反应历程如下,下列有关说法正确的是
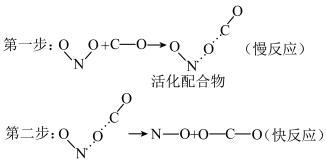
 的反应历程如下,下列有关说法正确的是
的反应历程如下,下列有关说法正确的是
| A.第二步活化配合物之间的碰撞一定是有效碰撞 |
| B.活化配合物的能量越高,第一步的反应速率越快 |
| C.第一步反应需要吸收能量 |
| D.该反应的反应速率主要取决于第二步反应 |
您最近一年使用:0次
2024-01-03更新
|
230次组卷
|
9卷引用:天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题
天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率重庆市大足中学2021-2022学年高二上学期第一次月考化学试题天津市第一中学2022-2023学年高三上学期1月期末质量检测化学试题(已下线)寒假作业02 化学反应速率-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题福建省德化一中、永安一中、漳平一中三校协作2021-2022学年高一下学期5月联考化学试题浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题山东省济宁市兖州区2023-2024学年高二上学期期中考试化学试题
23-24高三上·山东·阶段练习
名校
10 . 2022年诺贝尔化学奖授予了对点击化学和生物正交化学作出贡献的三位科学家。点击化学的代表反应为“叠氮化物炔烃”反应,其反应原理如图所示(R1和R2代表烷基)。下列说法正确的是
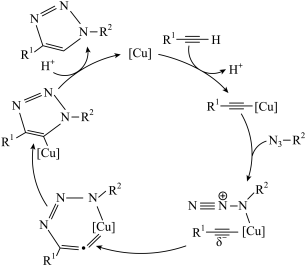

| A.整个反应中碳原子的杂化方式共有2种 |
B. 在[Cu]作用下,C-H键断裂并放出能量 在[Cu]作用下,C-H键断裂并放出能量 |
| C.该反应原理的总反应的原子利用率为100% |
| D.反应中[Cu]可降低反应的活化能,提高反应速率,降低焓变,提高平衡转化率 |
您最近一年使用:0次
2024-01-02更新
|
737次组卷
|
6卷引用:题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题(已下线)热点04 分子的空间结构山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题山东省名校联考2024届高三上学期模拟预测化学试题山东省济宁市第一中学2023-2024学年高三上学期2月期末化学试题