名校
解题方法
1 . 甲醇是重要的化工原料,利用合成气(CO、 、
、 )在催化剂的作用下合成甲醇,可能发生的反应如下:
)在催化剂的作用下合成甲醇,可能发生的反应如下:
①
 kJ/mol
kJ/mol

②
 kJ/mol
kJ/mol

③


(1)反应③的
_______ ,化学平衡常数 与
与 、
、 的代数关系是
的代数关系是
_______ 。
(2)反应②达平衡后,改变以下条件能使反应②的速率和两反应物转化率都增大的_______ (填标号)。
A.加压 B.升高温度 C.恒容充入氦气 D.恒容移走甲醇 E.恒容充入
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达平衡的是_______(填标号)。
(4)在一定温度和催化剂存在下,向1 L密闭容器中充入1 mol CO和2 mol  发生反应②。当CO的平衡转化率为50%时,产物甲醇的体积分数为
发生反应②。当CO的平衡转化率为50%时,产物甲醇的体积分数为_______ ,该温度下,正反应的平衡常数
_______ 。若向容器中再充入0.5 mol CO和1 mol  ,其他条件不变时平衡
,其他条件不变时平衡_______ 移动(填“正向”“逆向”“不”)。
(5)CO-空气碱性燃料电池(KOH作电解液),当恰好完全反应生成 时停止放电。写出此时负极的电极方程式:
时停止放电。写出此时负极的电极方程式:_______ 。
 、
、 )在催化剂的作用下合成甲醇,可能发生的反应如下:
)在催化剂的作用下合成甲醇,可能发生的反应如下:①

 kJ/mol
kJ/mol

②

 kJ/mol
kJ/mol

③



(1)反应③的

 与
与 、
、 的代数关系是
的代数关系是
(2)反应②达平衡后,改变以下条件能使反应②的速率和两反应物转化率都增大的
A.加压 B.升高温度 C.恒容充入氦气 D.恒容移走甲醇 E.恒容充入

(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达平衡的是_______(填标号)。
A. | B.混合气压强不变 |
C.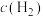 的浓度不变 的浓度不变 | D.混合气密度不变 |
 发生反应②。当CO的平衡转化率为50%时,产物甲醇的体积分数为
发生反应②。当CO的平衡转化率为50%时,产物甲醇的体积分数为
 ,其他条件不变时平衡
,其他条件不变时平衡(5)CO-空气碱性燃料电池(KOH作电解液),当恰好完全反应生成
 时停止放电。写出此时负极的电极方程式:
时停止放电。写出此时负极的电极方程式:
您最近一年使用:0次
2 . 设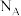 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
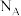 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.电解饱和食盐水得到0.4 mol NaOH,则生成氯气分子数为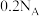 |
B.标准状况下,2.24 L  所含氢原子的数目等于 所含氢原子的数目等于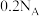 |
C. 和 和 反应,当产生2.24 L 反应,当产生2.24 L  时转移的电子数为 时转移的电子数为 |
D.密闭容器中,1 mol  与3 mol 与3 mol  反应制备氨气,形成 反应制备氨气,形成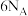 个N-H键 个N-H键 |
您最近一年使用:0次
2022-11-19更新
|
850次组卷
|
4卷引用:重庆市永川北山中学校2022-2023学年高三上学期期中质量监测化学试题
重庆市永川北山中学校2022-2023学年高三上学期期中质量监测化学试题重庆市万州第二高级中学2022-2023学年高三上学期12月线上检测化学试题 (已下线)回归教材重难点03 “NA”应用再思考-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)考点06 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
3 . Ⅰ.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g) SiO2(s)+4HF(g) ΔH=+148.9kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是_______(填字母序号)。
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:_______ 。
Ⅱ.碳及其化合物有广泛的用途。
(3)反应C(s)+H2O(g) CO(g)+H2(g)ΔH=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是_______。
CO(g)+H2(g)ΔH=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是_______。
(4)已知:C(s)+CO2(g) 2CO(g)△H=+172.5kJ•mol-1。则反应CO(g)+H2O(g)
2CO(g)△H=+172.5kJ•mol-1。则反应CO(g)+H2O(g) CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=_______ kJ•mol-1。
(5)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
①其它条件不变,降低温度,达到新平衡前v(逆)_______ v(正)(填“>”、“<”或“=”)。
②该温度下,此反应的平衡常数K=_______ ;
③其它条件不变,再充入0.1molCO和0.1molH2O(g),平衡时CO的体积分数_______ (填“增大”、“减小”或“不变”)。
 SiO2(s)+4HF(g) ΔH=+148.9kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9kJ·mol-1。(1)下列各项中能说明该反应已达化学平衡状态的是_______(填字母序号)。
| A.v消耗(SiF4)=4v生成(HF) |
| B.容器内气体压强不再变化 |
| C.容器内气体的总质量不再变化 |
| D.HF的体积分数不再变化 |
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
Ⅱ.碳及其化合物有广泛的用途。
(3)反应C(s)+H2O(g)
 CO(g)+H2(g)ΔH=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是_______。
CO(g)+H2(g)ΔH=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是_______。| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
 2CO(g)△H=+172.5kJ•mol-1。则反应CO(g)+H2O(g)
2CO(g)△H=+172.5kJ•mol-1。则反应CO(g)+H2O(g) CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=(5)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=
③其它条件不变,再充入0.1molCO和0.1molH2O(g),平衡时CO的体积分数
您最近一年使用:0次
4 . 在一定条件下,反应X(g)+3Y(g) 2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
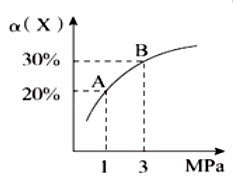
 2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
2Z(g) ∆H=-92.4kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是
| A.图中A,B两点,达到相同的平衡体系 |
| B.上述反应在达到平衡后,增大压强,Y的转化率提高 |
| C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 |
| D.将1.0molX、3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
您最近一年使用:0次
2021-11-02更新
|
566次组卷
|
3卷引用:重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题
名校
5 . 合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨:N2(g)+3H2(g) 2NH3(g)。T℃时,在2L恒容密闭容器中加入1.2molN2和2molH2模拟一定条件下工业固氮,体系中n(NH3)随时间的变化如图所示。下列说法错误的是
2NH3(g)。T℃时,在2L恒容密闭容器中加入1.2molN2和2molH2模拟一定条件下工业固氮,体系中n(NH3)随时间的变化如图所示。下列说法错误的是

 2NH3(g)。T℃时,在2L恒容密闭容器中加入1.2molN2和2molH2模拟一定条件下工业固氮,体系中n(NH3)随时间的变化如图所示。下列说法错误的是
2NH3(g)。T℃时,在2L恒容密闭容器中加入1.2molN2和2molH2模拟一定条件下工业固氮,体系中n(NH3)随时间的变化如图所示。下列说法错误的是
| A.2min内NH3的平均反应速率为0.1125mol•L−1•min−1 |
| B.T℃时,从2min到4min,反应的平衡常数不变 |
| C.容器内压强不再变化说明反应达到平衡,且3v正(H2)=2v逆(NH3) |
| D.T℃时,该反应的平衡常数为6.25L2•mol−2 |
您最近一年使用:0次
2021-10-09更新
|
316次组卷
|
2卷引用:重庆市永川北山中学校2022-2023学年高三上学期期中质量监测化学试题
名校
6 . 我国科学家利用如下反应实现了低温制氢。
CO(g) + H2O(g)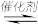 CO2(g) + H2(g)
CO2(g) + H2(g)
一定温度下,在密闭容器中,当 CO、H2O、CO2、H2 的浓度不再变化时,下列说法正确的是
CO(g) + H2O(g)
 CO2(g) + H2(g)
CO2(g) + H2(g)一定温度下,在密闭容器中,当 CO、H2O、CO2、H2 的浓度不再变化时,下列说法正确的是
| A.CO 和 H2O 全部转化为CO2 和H2 |
| B.该反应已达化学平衡状态 |
| C.正、逆反应速率相等且等于零 |
| D.CO、H2O、CO2、H2 的浓度一定相等 |
您最近一年使用:0次
2020-05-02更新
|
977次组卷
|
13卷引用:重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题
重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题北京市人大附中朝阳学校2019~2020年度第二学期高一年级阶段练习化学化学试题(合格班)2020年北京市第一次普通高中学业水平合格性考试化学试题北京师范大学附属中学2020-2021学年高一下学期期中考试化学(合格考班)试题北京市第五十六中学2020-2021学年高一下学期期中考试化学试题江苏省前黄高级中学2021-2022学年高二上学期合格性模拟测试化学试题甘肃省兰州第一中学2021-2022学年高一下学期期中考试化学试题北京市第十一中学2021-2022学年高一下学期6月月考化学试题新疆乌鲁木齐市第七十中学2021-2022学年高一下学期期中考试化学(文)试题天津市红桥区2020-2021学年高一下学期期末考试化学试题甘肃省武威第十八中学2021-2022学年高一下学期期末考试化学试题北京市密云二中2023-2024学年高二上学期10月月考化学试卷 (已下线)专题03 化学反应的速率与限度-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
名校
7 . 一定温度下,在体积为0.5 L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)  N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
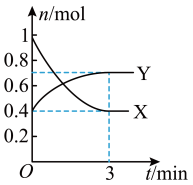
(1)曲线____ (填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)在0~3 min内,用NO2表示的反应速率为____________ 。
(3)下列叙述能说明该反应已达到化学平衡状态的是________ (填字母)。
a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)反应达到平衡后,若降低温度,则v(正)______ ,v(逆)________ 。(填“增大”“减小”或“不变”)。
 N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
(1)曲线
(2)在0~3 min内,用NO2表示的反应速率为
(3)下列叙述能说明该反应已达到化学平衡状态的是
a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)反应达到平衡后,若降低温度,则v(正)
您最近一年使用:0次
2017-04-20更新
|
332次组卷
|
5卷引用:重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题



