名校
1 . 甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol∙L−1,如果在甲瓶中加入少量的CaCO3晶体(mmol),在乙瓶中加入少量CaSO3晶体(mmol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲>乙 | D.乙>丙>甲 |
您最近一年使用:0次
2021-11-07更新
|
263次组卷
|
2卷引用:甘肃省武威第六中学2022-2023学年高三上学期第三次过关考试化学试题
名校
2 . 温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
 PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1 |
| B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) |
| D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的物质的量大于0.4 mol |
您最近一年使用:0次
2021-11-01更新
|
385次组卷
|
4卷引用:甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题
甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题(已下线)2021年6月浙江高考化学试题变式题11-20山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题11-16)
名校
3 . 一定量混合气体在一体积可变的密闭容器中发生反应:xA(g)+yB(g) zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
 zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1.在恒温下将密闭容器的体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是| A.平衡向正反应方向移动 | B.x+y<z |
| C.B的转化率升高 | D.C的体积分数降低 |
您最近一年使用:0次
2021-11-01更新
|
197次组卷
|
15卷引用:2016-2017学年甘肃省民乐一中高二上10月月考化学试卷
2016-2017学年甘肃省民乐一中高二上10月月考化学试卷甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷2016-2017学年河北省定州二中高二上学期第一次月考化学试卷山西大学附属中学2017-2018学年高二上学期10月模块诊断化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题高二人教版选修4 第二章 第三节 化学平衡安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题云南省景谷一中2018-2019学年高二下学期期末考试化学试题福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题广东省江门市新会第一中学2022-2023学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第43练 化学平衡移动原理及应用吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题河南省周口市文昌中学2023-2024学年高三上学期12月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
4 . 下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色NO2加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色NO2加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥向MgCO3沉淀中滴加NaOH溶液可以得到Mg(OH)2沉淀
| A.②⑤ | B.①③⑤ | C.①②⑥ | D.②③④ |
您最近一年使用:0次
名校
5 . 在某一绝热恒容容器里,充入一定量NH3和CO2,只发生反应:2NH3(g)+CO2(g)  H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是
H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是
 H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是
H2NCOONH4(s) ΔH=-159.47 kJ·mol-1,达到平衡状态后改变某一条件后发生下列变化能说明平衡一定向正反应方向移动的是| A.正反应速率先增大后减小 | B.逆反应速率先不变后减小 |
| C.容器内温度降低 | D.某反应物的体积百分含量增大 |
您最近一年使用:0次
2021-10-21更新
|
162次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题
6 . 低温脱氮技术可用于处理废弃中的氮氧化物。发生的化学反应为:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)+Q。在恒容密闭容器中,下列说法正确的是
5N2(g)+6H2O(g)+Q。在恒容密闭容器中,下列说法正确的是
 5N2(g)+6H2O(g)+Q。在恒容密闭容器中,下列说法正确的是
5N2(g)+6H2O(g)+Q。在恒容密闭容器中,下列说法正确的是| A.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| B.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
| C.4mol氨气与足量的NO充分反应,放出的热量为Q |
| D.增大压强,正逆反应速率都增大,平衡逆向移动 |
您最近一年使用:0次
2021-06-25更新
|
695次组卷
|
4卷引用:甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题
甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题上海市虹口区2020-2021学年高一下学期期末学生学习能力诊断测试化学试题(已下线)第二章 第三节化学平衡(第2课时 化学平衡的影响因素)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(原卷版)(已下线)第2章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
名校
解题方法
7 . 近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)  pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
(1)反应2 min内,vA=___________ ,vB=___________ ;
(2)反应平衡时,D为2a mol,则B的转化率为___________ ;
(3)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH___________ 0(填“>”、“<” 或“=”);
(4) 如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率___________ (填“增大”、“减小”或“不变”)
②平衡时反应物的转化率___________ (填“增大”、“减小”或“不变”)
 pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成。回答下列问题:(1)反应2 min内,vA=
(2)反应平衡时,D为2a mol,则B的转化率为
(3)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH
(4) 如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率
②平衡时反应物的转化率
您最近一年使用:0次
8 . 一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g)=2CO(g) ΔH=+173 kJ·mol-1,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:

(1)650 ℃时CO2的平衡转化率为___________ 。
(2)t1 ℃时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);该温度下达平衡后若再充入等物质的量的CO和CO2气体,则平衡___________ (填“正向”“逆向”或“不”)移动,原因是___________ 。

(1)650 ℃时CO2的平衡转化率为
(2)t1 ℃时平衡常数Kp=
您最近一年使用:0次
2021-05-07更新
|
670次组卷
|
5卷引用:甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题
甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期期中考试化学试题(已下线)小题29 化学平衡的相关计算——备战2021年高考化学经典小题考前必刷(全国通用)江苏省扬州市高邮市临泽中学2021-2022学年高二9月阶段测试化学试卷江苏省高邮市临泽镇高中2021-2022学年高二上学期9月阶段测试化学试题浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题
名校
9 . 在容积不变的密闭容器中,一定条件下进行如下反应:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-373.2kJ·mol-1。如图曲线a表示该反应过程中NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是
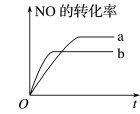
| A.降低温度 |
| B.向密闭容器中通入氩气 |
| C.加催化剂 |
| D.增大反应物中NO的浓度 |
您最近一年使用:0次
2021-03-24更新
|
263次组卷
|
9卷引用:甘肃省临泽县第一中学2018-2019学年高二上学期期中考试化学试题
甘肃省临泽县第一中学2018-2019学年高二上学期期中考试化学试题广西南宁市第三中学2017-2018学年高二上学期期末考试化学试题2020届高三化学知识点强化训练—化学平衡的移动及影响因素鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二上学期期末考试化学试题重庆市天星桥中学2021-2022学年高二上学期第二次月考化学试题章末检测卷(二)化学反应的方向、限度与速率陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题上海市进才中学2023-2024学年高一下学期期中考试化学试卷(等级)
名校
解题方法
10 . 下列变化不能 用勒夏特列平衡移动原理释解的是
| A.工业生产硫酸的过程中使用适当过量的氧气,以提高二氧化硫的转化率 |
| B.红棕色的NO2加压后颜色先变深再变浅 |
| C.光照新制的氯水,溶液的酸性增强 |
| D.工业合成氨的反应,往往需要使用催化剂 |
您最近一年使用:0次
2021-01-28更新
|
573次组卷
|
3卷引用:甘肃省天水市第一中学2021-2022学年高二上学期第一学段考试化学(理)试题
甘肃省天水市第一中学2021-2022学年高二上学期第一学段考试化学(理)试题湖北省部分高中2020-2021学年高二上学期期中考试化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)



