1 .  可用作有机合成的氯化剂。在体积为
可用作有机合成的氯化剂。在体积为 的密闭容器中充入
的密闭容器中充入 ,发生反应:
,发生反应: ,图中所示曲线分别表示反应在
,图中所示曲线分别表示反应在 时和平衡时
时和平衡时 的转化率
的转化率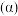 与温度
与温度 的关系。下列说法正确的是
的关系。下列说法正确的是

 可用作有机合成的氯化剂。在体积为
可用作有机合成的氯化剂。在体积为 的密闭容器中充入
的密闭容器中充入 ,发生反应:
,发生反应: ,图中所示曲线分别表示反应在
,图中所示曲线分别表示反应在 时和平衡时
时和平衡时 的转化率
的转化率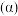 与温度
与温度 的关系。下列说法正确的是
的关系。下列说法正确的是 
A. 的 的 |
B. ,从 ,从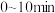 ,以 ,以 表示反应的平均速率为 表示反应的平均速率为 |
| C.当容器中混合气体的平均相对分子质量恒定不变时,反应达到平衡状态 |
D.82℃,若起始时在该密闭容器中充入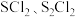 和 和 各 各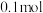 ,则此时v(逆)>v(正) ,则此时v(逆)>v(正) |
您最近一年使用:0次
2022-04-22更新
|
1227次组卷
|
11卷引用:浙江省“山水联盟”2021届高三4月联考化学试题
浙江省“山水联盟”2021届高三4月联考化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)辽宁省锦州市2022届高三第一次质量检测化学试题湖南省隆回县第一中学2022届高三下学期第二次模拟考试化学试题(已下线)化学-2022年高考考前押题密卷(北京卷)辽宁省锦州市2022届高三下学期质量检测化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)重庆市西南大学附属中学校2022-2023学年高三上学期开学定时训练化学试题(已下线)题型23 平衡常数、平衡转化率图象(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建
名校
2 . 已知反应式: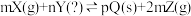 ,已知反应已达平衡,此时
,已知反应已达平衡,此时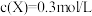 ,其他条件不变,若容器缩小到原来的
,其他条件不变,若容器缩小到原来的 ,
,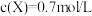 ,下列说法不正确的是
,下列说法不正确的是
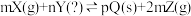 ,已知反应已达平衡,此时
,已知反应已达平衡,此时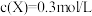 ,其他条件不变,若容器缩小到原来的
,其他条件不变,若容器缩小到原来的 ,
,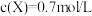 ,下列说法不正确的是
,下列说法不正确的是A.系数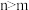 | B.反应向逆方向移动 |
| C.Y可能是固体或液体 | D.Z的体积分数减小 |
您最近一年使用:0次
2021-11-05更新
|
776次组卷
|
7卷引用:新疆维吾尔自治区喀什市2021-2022学年高三上学期全真模拟化学试题
新疆维吾尔自治区喀什市2021-2022学年高三上学期全真模拟化学试题广东省广州市部分学校2021-2022学年高二上学期期中联考化学试题广东省广州市六校联考2021-2022学年高二上学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期期末线上测试化学试题广东省广州市2022-2023学年高二上学期期中考试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
名校
3 . 温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
 PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经一段时间后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1 |
| B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) |
| D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的物质的量大于0.4 mol |
您最近一年使用:0次
2021-11-01更新
|
385次组卷
|
4卷引用:2021年6月浙江高考化学试题变式题11-20
(已下线)2021年6月浙江高考化学试题变式题11-20甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(实验班)化学试题山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(选择题11-16)
名校
4 . 下列关于化学平衡的叙述,正确的是
A.2NO2(g)  N2O4(g) ΔH < 0,反应达平衡后,压缩体系体积,平衡正向移动,体系颜色变浅 N2O4(g) ΔH < 0,反应达平衡后,压缩体系体积,平衡正向移动,体系颜色变浅 |
B.H2(g)+I2(g)  2HI(g) ΔH < 0,反应达平衡后,增大体系体积,平衡不移动,体系颜色不变 2HI(g) ΔH < 0,反应达平衡后,增大体系体积,平衡不移动,体系颜色不变 |
C.FeCl3(aq)+3KSCN(aq)  Fe(SCN)3(aq)+3KCl(aq),反应达平衡后,向体系中加入少量 KCl 固体,平衡逆向移动,体系颜色变浅 Fe(SCN)3(aq)+3KCl(aq),反应达平衡后,向体系中加入少量 KCl 固体,平衡逆向移动,体系颜色变浅 |
D.N2(g)+3H2(g)  2NH3(g),反应达平衡后,保持体系压强不变,充入He,平衡逆向移动,体系中NH3的体积分数减小 2NH3(g),反应达平衡后,保持体系压强不变,充入He,平衡逆向移动,体系中NH3的体积分数减小 |
您最近一年使用:0次
2021-10-13更新
|
746次组卷
|
10卷引用:2021年辽宁高考化学试题变式题11-19
2021年辽宁高考化学试题变式题11-19重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题四川省成都外国语学校2021-2022学年高二上学期10月月考化学试题江西省吉安市遂川中学2021-2022学年高二上学期第三次月考(B)化学试题四川省成都市第七中学2020-2021学年高二上学期十月阶段性考试化学试题安徽省池州市第一中学2020-2021学年高二上学期期中考试化学试题江西省南昌市八一中学2020-2021学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2021-2022学年高二下学期第一次月考化学试题黑龙江省牡丹江穆棱市第二中学2021-2022学年高二上学期期末考试化学试题
名校
5 . 在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:aA(g)+bB(s) mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
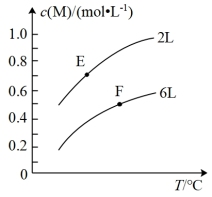
 mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
mM(g)+nN(g) △H=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列有关判断一定正确的是
| A.a>m+n | B.达到平衡后,增大B的量将会提高A的转化率 |
| C.E点的平衡常数小于F点的平衡常数 | D.Q>0 |
您最近一年使用:0次
2021-09-27更新
|
994次组卷
|
8卷引用:湖南省湘潭市2022届高三第一模拟考试化学试题
名校
6 . 二甲醚(DME)正逐渐替代化石燃料。有多种方法制备二甲醚,回答下列问题。
(1)合成气制二甲醚:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
①已知:H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1,H2(g)的燃烧热ΔH=-285.8 kJ·mol-1,CO(g)的燃烧热ΔH=-283.0 kJ·mol-1。则二甲醚的燃烧热ΔH=________ kJ·mol-1。
②300 ℃,1 L恒容密闭容器中充入4 mol H2和2 mol CO,测得容器内压强变化如下:
反应进行到20 min时,H2的转化率为________ ,CO的平均反应速率v(CO)=________ mol·L-1·min-1。该温度下的平衡常数K=________ (mol·L)-4。
(2)CO2催化加氢制二甲醚,可以实现CO2的再利用。该过程主要发生如下反应:
Ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1
CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1
Ⅱ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
恒压条件下,CO2、H2起始量相等时,CO2的平衡转化率和CH3OCH3的选择性随温度变化如图。已知:CH3OCH3的选择性

①300 ℃时,通入CO2、H2各1 mol,平衡时CH3OCH3的选择性、CO2的平衡转化率都为30%,平衡时生成CH3OCH3的物质的量=________ mol。温度高于300 ℃,CO2的平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,CO2和H2反应一段时间后,测得A点CH3OCH3的选择性为48%,不改变反应时间和温度,一定能提高CH3OCH3的选择性的措施有________ 。
(1)合成气制二甲醚:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1①已知:H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1,H2(g)的燃烧热ΔH=-285.8 kJ·mol-1,CO(g)的燃烧热ΔH=-283.0 kJ·mol-1。则二甲醚的燃烧热ΔH=
②300 ℃,1 L恒容密闭容器中充入4 mol H2和2 mol CO,测得容器内压强变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
(2)CO2催化加氢制二甲醚,可以实现CO2的再利用。该过程主要发生如下反应:
Ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1
CO(g)+H2O(g) ΔH=+41.7 kJ·mol-1Ⅱ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1恒压条件下,CO2、H2起始量相等时,CO2的平衡转化率和CH3OCH3的选择性随温度变化如图。已知:CH3OCH3的选择性


①300 ℃时,通入CO2、H2各1 mol,平衡时CH3OCH3的选择性、CO2的平衡转化率都为30%,平衡时生成CH3OCH3的物质的量=
②220 ℃时,CO2和H2反应一段时间后,测得A点CH3OCH3的选择性为48%,不改变反应时间和温度,一定能提高CH3OCH3的选择性的措施有
您最近一年使用:0次
2021-07-20更新
|
721次组卷
|
4卷引用:重庆市第十一中学校2021届高三下学期4月二诊化学试题
重庆市第十一中学校2021届高三下学期4月二诊化学试题2021年河北省高考化学试卷变式题10-18题湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
7 . 金属铝有广泛的应用,有人对碳还原氧化铝制备铝进行了实验研究。在2.0 L真空密闭容器中稍过量石墨与1.0 mol Al2O3混合后加热,图1是体系压强随着加热时间变化的曲线图,图2是在不同的恒定温度下,反应达到平衡,冷却后容器内剩余固体中部分 含铝元素物质的物质的量随温度变化曲线图。

已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s) 2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
反应II:2Al2O3(s)+9C(s) Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
反应III:Al2O3(s)+Al4C3(s) 6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3
请回答下列问题:
(1)工业上电解法冶炼铝的化学方程式为___ 。
(2)△H3=___ 。
(3)图1中石墨与Al2O3混合物加热至150 min时容器内温度约为___ 。
(4)从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是___ 。
(5)由图2可得1650 K时,反应I的平衡常数K=___ 。
(6)下列说法不正确 的是___ 。
A.图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动
B.图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度
C.图2中T≥1700K时体系中一定还发生了其他副反应
D.综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
(7)请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图___ 。


已知:1.01×105 Pa下Al熔点933 K,沸点2700 K;10 Pa下Al沸点低于1000 K,Al2O3和C沸点高于2000 K。
反应I:Al2O3(s)+3C(s)
 2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1
2Al(s)+3CO(g) △H1=+1339.1 kJ·mol-1反应II:2Al2O3(s)+9C(s)
 Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1
Al4C3(s)+6CO(g) △H2=+2249.5 kJ·mol-1反应III:Al2O3(s)+Al4C3(s)
 6Al(s)+3CO(g) △H3
6Al(s)+3CO(g) △H3请回答下列问题:
(1)工业上电解法冶炼铝的化学方程式为
(2)△H3=
(3)图1中石墨与Al2O3混合物加热至150 min时容器内温度约为
(4)从反应自发性推测,实验室进行碳还原氧化铝制备铝的实验需要在真空容器中进行,可能的原因是
(5)由图2可得1650 K时,反应I的平衡常数K=
(6)下列说法
A.图1中约170 min后体系压强很快减小可能是反应I、II急剧发生,吸收了大量的热,容器内温度降低,导致反应I、II平衡向逆方向移动
B.图2显示约1650~1700 K之间是石墨与Al2O3反应制备Al的最佳温度
C.图2中T≥1700K时体系中一定还发生了其他副反应
D.综合分析可得,碳还原氧化铝制备铝比电解法成本更低,产率更高,适合大规模应用
(7)请在图3中画出温度在1450-1650 K之间2.0 L真空密闭容器中CO的浓度随温度变化曲线图

您最近一年使用:0次
8 . 甲醇是重要的化工原料,又可作为燃料。以CO2和H2为原料生产甲醇时,同时发生下列两个反应,反应的热化学方程式如下:
I.
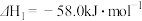
II.
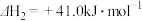
(1)上述两个反应中,在热力学上趋势较大的是____ (填反应代号)。
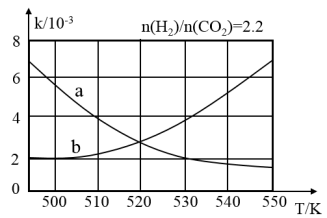
(2)下图中表示反应II平衡常数K随温度变化关系的曲线为__ (填曲线标记字母),其判断依据是___ 。
(3)CO和H2反应也可生成气态甲醇。相关的化学键键能数据如下:
①则x=______ 。
②CO和H2生成甲醇的反应,体系总压强为P MPa恒定,在温度T时,起始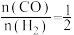 ,若到达平衡时,CO的转化率为50%,则平衡常数Kp=
,若到达平衡时,CO的转化率为50%,则平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)某实验室控制CO2和H2初始投料比为1:2.2。在相同压强下,发生I、II两个反应,经过相同反应时间测得如下实验数据如图A、图B所示:
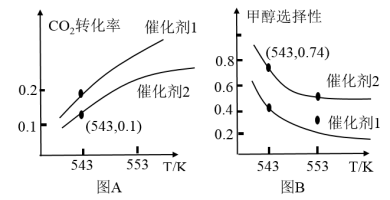
①有利于提高CO2转化为CH3OH平衡转化率的措施有_______ 。
A.使用催化剂1
B.增大CO2和H2的初始投料比
C.使用催化剂2
D.投料比不变,增加反应物的浓度
②在催化剂2的作用下,543 K时,CO的选择性(CO2转化为CO的体积百分比)为____ ,H2的转化率为____ (保留两位有效数字)。
I.

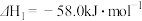
II.

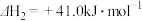
(1)上述两个反应中,在热力学上趋势较大的是
(2)下图中表示反应II平衡常数K随温度变化关系的曲线为

(3)CO和H2反应也可生成气态甲醇。相关的化学键键能数据如下:
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 |  |
①则x=
②CO和H2生成甲醇的反应,体系总压强为P MPa恒定,在温度T时,起始
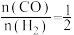 ,若到达平衡时,CO的转化率为50%,则平衡常数Kp=
,若到达平衡时,CO的转化率为50%,则平衡常数Kp=(4)某实验室控制CO2和H2初始投料比为1:2.2。在相同压强下,发生I、II两个反应,经过相同反应时间测得如下实验数据如图A、图B所示:

①有利于提高CO2转化为CH3OH平衡转化率的措施有
A.使用催化剂1
B.增大CO2和H2的初始投料比
C.使用催化剂2
D.投料比不变,增加反应物的浓度
②在催化剂2的作用下,543 K时,CO的选择性(CO2转化为CO的体积百分比)为
您最近一年使用:0次
2021-06-28更新
|
474次组卷
|
2卷引用:2021年辽宁高考化学试题变式题11-19
名校
解题方法
9 . 二氧化钛和三氧化钨(TiO2/WO3)纳米异质结薄膜广泛应用于光催化、光电催化和传感器等领域。从废弃薄膜中回收钛和钨等稀缺金属既有利于资源综合利用又避免污染环境,以下是TiO2/WO3纳米异质结薄膜回收的工艺流程:

已知:
Ⅰ.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2,呈碱性,与酸发生反应:CH3CH2NH2+H+=CH3CH2NH
Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2CH3CH2NH +WO
+WO
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4
Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2,室温时,Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:
(1)TiOSO4中Ti的化合价是___ 。
(2)为了达到最佳萃取效果,应该在萃取前将滤液Ⅰ的pH调节至___ 。(填“弱酸性”或“弱碱性”)
(3)写出“反萃取”步骤中生成(NH4)2WO4的化学方程式:___ 。
(4)“过滤Ⅲ”所得滤液中,溶质的主要成分是___ (填物质名称)。
(5)将“酸煮”所得TiOSO4溶液稀释到0.001mol·L-1,冷却至室温时恰好产生沉淀,此时溶液的pH为___ 。
(6)最新研究发现,可以用如图所示装置由TiO2获得金属钛,电解质为熔融CaO,在制备金属钛前后,装置中CaO的质量___ (填“增大”“减小”或“不变”)。

若将熔融状态的CaO换成Ca(NO3)2溶液___ (填“可以”或“不可以”)达到相同的目的,解释原因:___ 。

已知:
Ⅰ.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2,呈碱性,与酸发生反应:CH3CH2NH2+H+=CH3CH2NH

Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2CH3CH2NH
 +WO
+WO
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2,室温时,Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:
(1)TiOSO4中Ti的化合价是
(2)为了达到最佳萃取效果,应该在萃取前将滤液Ⅰ的pH调节至
(3)写出“反萃取”步骤中生成(NH4)2WO4的化学方程式:
(4)“过滤Ⅲ”所得滤液中,溶质的主要成分是
(5)将“酸煮”所得TiOSO4溶液稀释到0.001mol·L-1,冷却至室温时恰好产生沉淀,此时溶液的pH为
(6)最新研究发现,可以用如图所示装置由TiO2获得金属钛,电解质为熔融CaO,在制备金属钛前后,装置中CaO的质量

若将熔融状态的CaO换成Ca(NO3)2溶液
您最近一年使用:0次
10 . “加大力度保护自然,实现可持续发展”是第五届联合国环境大会会议主题。工业生产产生的含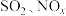 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
(1)在一定条件下,肼( )与
)与 反应能生成
反应能生成 和
和 。
。
已知:①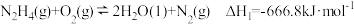 ;
;
②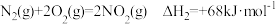 ;
;
③ ;
;
则反应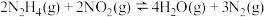 的
的
_______  。
。
(2)在一恒容密闭容器中发生反应: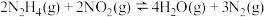 。当温度高于250℃时,正、逆反应速率分别为
。当温度高于250℃时,正、逆反应速率分别为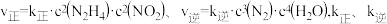 分别为正、逆反应速率常数,
分别为正、逆反应速率常数, 、
、 与该反应的平衡常数
与该反应的平衡常数 之间的关系为
之间的关系为_______ 。速率常数 随温度的升高而增大,则达到平衡后,仅升高温度,
随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“>”、“<”或“=”) 增大的倍数。
增大的倍数。
(3)在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为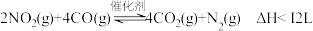 。向两个容积均为2L的恒容密闭容器中均分别充入
。向两个容积均为2L的恒容密闭容器中均分别充入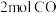 和
和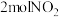 ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为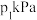 ,曲线II代表的体系平衡后气体的总压强为
,曲线II代表的体系平衡后气体的总压强为 。
。
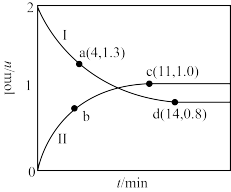
①代表220℃条件下的变化曲线为___ (填“I”或“II”);ad段 的平均反应速率为
的平均反应速率为__  。
。
②下列有关曲线II条件下的反应的说法正确的是_______ (填标号)。
A.当体系中 与
与 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
的转化率
③图中a、c、d三点对应的逆反应速率由大到小的顺序为_______ (用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp=_______  (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
(Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
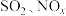 的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。
的烟气对环境和人体健康有极大的危害,必须经过处理才可排放。(1)在一定条件下,肼(
 )与
)与 反应能生成
反应能生成 和
和 。
。已知:①
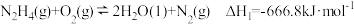 ;
;②
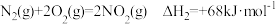 ;
;③
 ;
;则反应
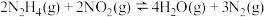 的
的
 。
。(2)在一恒容密闭容器中发生反应:
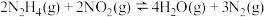 。当温度高于250℃时,正、逆反应速率分别为
。当温度高于250℃时,正、逆反应速率分别为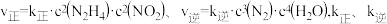 分别为正、逆反应速率常数,
分别为正、逆反应速率常数, 、
、 与该反应的平衡常数
与该反应的平衡常数 之间的关系为
之间的关系为 随温度的升高而增大,则达到平衡后,仅升高温度,
随温度的升高而增大,则达到平衡后,仅升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)在一定条件下,利用催化净化技术,CO可将NO2转化为无毒物质反应为
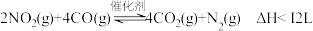 。向两个容积均为2L的恒容密闭容器中均分别充入
。向两个容积均为2L的恒容密闭容器中均分别充入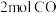 和
和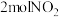 ,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为
,分别在220℃和300℃下发生反应。测得两容器中CO或CO2的物质的量随时间的变化关系如图所示,曲线I代表的体系平衡后气体的总压强为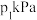 ,曲线II代表的体系平衡后气体的总压强为
,曲线II代表的体系平衡后气体的总压强为 。
。
①代表220℃条件下的变化曲线为
 的平均反应速率为
的平均反应速率为 。
。②下列有关曲线II条件下的反应的说法正确的是
A.当体系中
 与
与 的物质的量之比不随时间变化时,反应达到平衡状态
的物质的量之比不随时间变化时,反应达到平衡状态B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高
 的转化率
的转化率③图中a、c、d三点对应的逆反应速率由大到小的顺序为
 (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
(Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
2021-05-27更新
|
408次组卷
|
6卷引用:辽宁省沈阳郊联体2021届高三5月四模化学试题



