解题方法
1 . 某实验小组从某废旧锂离子电池正极活性材料(主要成分可表示为 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: 、
、 、
、 、
、 ;
;
②有关金属离子沉淀完全的 见下表:
见下表:
(1)丁二酮肟分子中 杂化的碳原子个数为
杂化的碳原子个数为______ ,二丁二酮肟镍中存在的化学键有______ (填序号)。
A. 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键
(2)“氧化”过程的操作为控制体系的 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式______ 。
(3)P507萃取剂(用HA表示)萃取 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为______ 。 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为______ 。
(5)将草酸钴晶体 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为______ 。 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为______ 。
 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: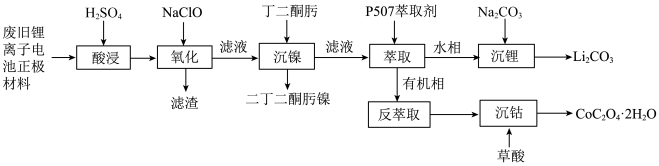
 、
、 、
、 、
、 ;
;②有关金属离子沉淀完全的
 见下表:
见下表:离子 |
|
|
|
|
| 9.3 | 3.2 | 9.0 | 8.9 |
③沉镍反应为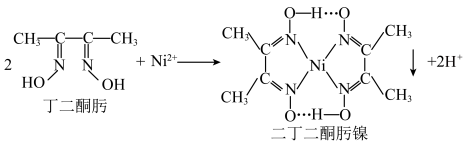
(1)丁二酮肟分子中
 杂化的碳原子个数为
杂化的碳原子个数为A.
 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键(2)“氧化”过程的操作为控制体系的
 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式(3)P507萃取剂(用HA表示)萃取
 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为
 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为(5)将草酸钴晶体
 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为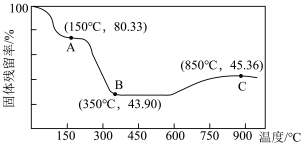
 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出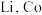 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为
您最近一年使用:0次
解题方法
2 . 水热法制备 的流程如图,下列叙述正确的是
的流程如图,下列叙述正确的是
 的流程如图,下列叙述正确的是
的流程如图,下列叙述正确的是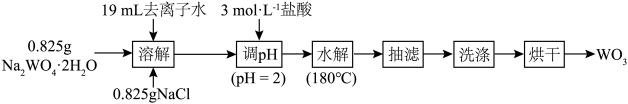
| A.本实验使用托盘天平称量 | B. 作反应的氧化剂 作反应的氧化剂 |
C.调 为2的目的是促进反应完全 为2的目的是促进反应完全 | D.用 溶液检验产品是否洗净 溶液检验产品是否洗净 |
您最近一年使用:0次
名校
3 . 一种从某钒矿石(主要成分为 、
、 、
、 和
和 )中提钒的工艺流程如图所示。已知
)中提钒的工艺流程如图所示。已知 能够萃取溶液中的
能够萃取溶液中的 ,且萃取
,且萃取 的原理为
的原理为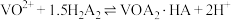 。下列说法正确的是
。下列说法正确的是
 、
、 、
、 和
和 )中提钒的工艺流程如图所示。已知
)中提钒的工艺流程如图所示。已知 能够萃取溶液中的
能够萃取溶液中的 ,且萃取
,且萃取 的原理为
的原理为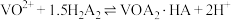 。下列说法正确的是
。下列说法正确的是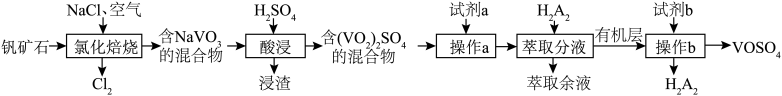
A.试剂a可选用的是 、 、 、 、 等 等 |
B.试剂b可选用的是KOH、NaOH、 等 等 |
| C.“酸浸”“操作b”的过程中均有氧化还原反应发生 |
| D.“操作b”使用的主要玻璃仪器有分液漏斗、烧杯 |
您最近一年使用:0次
4 . 下列实验操作及现象、对应结论不正确的是
选项 | 实验操作及现象 | 结论 |
A | 向重铬酸钾溶液中加水,溶液颜色变浅 | 增加水的用量,平衡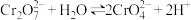 向右移动 向右移动 |
B | 向含酚酞的 溶液中加入 溶液中加入 固体,溶液红色变浅 固体,溶液红色变浅 |  溶液中存在水解平衡 溶液中存在水解平衡 |
C | 向硫酸铜溶液中滴加浓氨水至过量,溶液先产生蓝色沉淀,然后沉淀溶解变为深蓝色溶液 |  转化为 转化为 |
D |  时,向 时,向 溶液中滴加甲基橙溶液,溶液变红 溶液中滴加甲基橙溶液,溶液变红 | 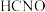 的电离平衡常数大于 的电离平衡常数大于 的电离平衡常数 的电离平衡常数 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 在体积为1 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
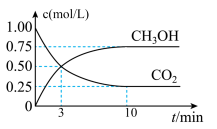
| A.该化学反应在3 min时达到平衡状态 |
| B.保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol·L-1,则该反应的ΔH >0 |
| C.相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率为75% |
| D.12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向正反应方向进行 |
您最近一年使用:0次
2023-12-23更新
|
122次组卷
|
3卷引用:河北省衡水市安平中学2023-2024学年高二下学期开学考试化学试题
真题
名校
6 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: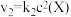 和
和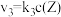 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: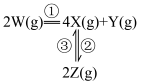
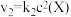 和
和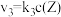 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
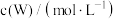 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.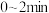 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若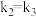 ,平衡时 ,平衡时 |
D.若升高温度,平衡时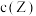 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
2961次组卷
|
4卷引用:河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题
名校
解题方法
7 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近一年使用:0次
2023-11-14更新
|
360次组卷
|
25卷引用:河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题
河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
名校
8 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
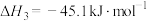
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

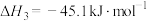
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。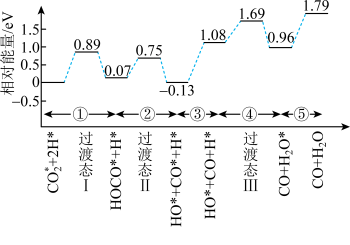

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。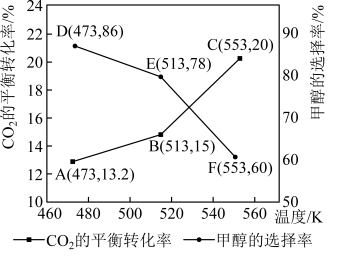
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
254次组卷
|
5卷引用:河北省衡水中学2023-2024学年高三上学期一调考试化学试题
名校
9 . 电池正极片由镍钴锰酸锂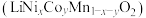 正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
(1)滤液1中含铝微粒为___________ 。
(2)“碱浸”后需进行过滤、洗涤,简述洗涤的操作过程:___________ 。
(3)“还原”时,参加反应的
___________ 。
(4)“分离”过程包含萃取和反萃取,萃取时必须使用的仪器是___________ ;萃取时利用有机物HT将Co2+从水溶液中萃取出来,该过程可表示为Co2+(水层)+2HT(有机层) CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:
CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:___________ 。
(5)“氧化”过程中MnSO4发生反应生成MnO2、(NH4)2SO4和H2SO4的化学方程式为___________ 。
(6)“沉钴”后获得CoC2O4·2H2O,取mgCoC2O4·2H2O进行“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
)与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:___________ ;“高温分解”需控制的最低温度为___________ 。
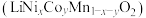 正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
正极材料和铝片组成,以其为原料回收各金属工艺流程如下:
(1)滤液1中含铝微粒为
(2)“碱浸”后需进行过滤、洗涤,简述洗涤的操作过程:
(3)“还原”时,参加反应的

(4)“分离”过程包含萃取和反萃取,萃取时必须使用的仪器是
 CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:
CoT2(有机层)+2H+(水层)。向CoT2(有机层)中加入稀硫酸能获得较纯的含Co2+的水溶液,从平衡角度解释其原因:(5)“氧化”过程中MnSO4发生反应生成MnO2、(NH4)2SO4和H2SO4的化学方程式为
(6)“沉钴”后获得CoC2O4·2H2O,取mgCoC2O4·2H2O进行“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
)与温度的关系曲线如图所示。写出加热到160℃时反应的化学方程式:
您最近一年使用:0次
名校
10 . 为实现下列实验目的,橙子辅导小组成员们的实验操作、实验现象和结论不正确的是
| 选项 | 实验目的 | 实验操作 | 现象和结论 |
| A | 探究氢离子浓度对CrO 、Cr2O 、Cr2O 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加稀硫酸,观察实验现象 | 溶液由黄色变为橙红色,则说明增大氢离子浓度,转化平衡向生成Cr2O 的方向移动 的方向移动 |
| B | 探究常温下,氯化银与碘化银的溶度积大小 | 常温下,向盛有2滴0.1mol·L-1AgNO3溶液的试管中滴加1mL0.1mol·L-1NaCl溶液,再向其中滴加1mL0.1mol·L-1KI溶液 | 先有白色沉淀生成,后又产生黄色沉淀,溶度积:Ksp(AgCl)>Ksp(AgI) |
| C | 验证压强对化学平衡的影响 | 先将注射器充满NO2气体,然后将活塞往里推 | 注射器内气体颜色加深,证明加压平衡向生成NO2气体的方向移动 |
| D | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 若溶液红色变浅,证明Na2CO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-06更新
|
101次组卷
|
2卷引用:河北省石家庄市第二十四中学2023-2024高二上学期期末考试化学试题




