解题方法
1 . K2Cr2O7溶液中存在平衡: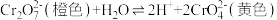 。
。
(1)向2mL0.1mol/LK2Cr2O7溶液中滴加5滴6mol/LNaOH溶液。可观察到的现象是_______ ;得出的结论是:_______ 。
(2)向上述溶液中再滴加10滴6mol/LH2SO4溶液。可观察到的现象是_______ ;得出的结论是_______ 。
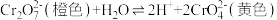 。
。(1)向2mL0.1mol/LK2Cr2O7溶液中滴加5滴6mol/LNaOH溶液。可观察到的现象是
(2)向上述溶液中再滴加10滴6mol/LH2SO4溶液。可观察到的现象是
您最近一年使用:0次
解题方法
2 . 已知 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
Ⅰ.方案讨论
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是___________ (填序号)。
(2)已知 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着___________ (填“正反应”或“逆反应”)方向移动,溶液颜色将___________ (填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
(3)实验ⅰ没有观察到预期现象的原因是___________ ,实验ⅱ的原因与其相似。
(4)通过实验ⅲ和ⅳ得出的结论为___________ 。
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸___________ (填“能”或“不能”)达到预期目的,理由是___________ 。
(6)某同学查阅资料发现: 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
①方案一:取5mL浓盐酸,向其中加入15滴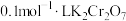 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式___________ 。
②请你设计方案二:___________ 。
 溶液中存在平衡:
溶液中存在平衡:
 。
。 溶液为橙色,
溶液为橙色, 溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
溶液为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。 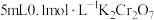 溶液 溶液 | 序号 | 试剂X |
| ⅰ | 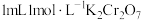 溶液 溶液 | |
| ⅱ | 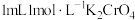 溶液 溶液 | |
| ⅲ | 5~15滴浓盐酸 | |
| ⅳ | 5~15滴 溶液 溶液 |
(1)ⅰ~ⅳ中依据减少生成物浓度可导致平衡移动的原理设计的是
(2)已知
 为黄色沉淀。某同学认为试剂X还可设计为
为黄色沉淀。某同学认为试剂X还可设计为 溶液,加入该试剂后,平衡向着
溶液,加入该试剂后,平衡向着Ⅱ.实验分析
| 序号 | 试剂X | 预期现象 | 实际现象 |
| ⅰ | 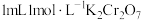 溶液 溶液 | 溶液变黄 | 溶液橙色加深 |
| ⅱ | 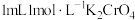 溶液 溶液 | 溶液橙色加深 | 溶液颜色变浅 |
| ⅲ | 5~15滴浓盐酸 | 溶液橙色加深 | 溶液橙色加深 |
| ⅳ | 5~15滴 溶液 溶液 | 溶液变黄 | 溶液变黄 |
(3)实验ⅰ没有观察到预期现象的原因是
(4)通过实验ⅲ和ⅳ得出的结论为
(5)某同学认为将ⅲ中浓盐酸替换为浓硫酸也可得出相应的实验结论。用浓硫酸替换浓盐酸
(6)某同学查阅资料发现:
 溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
溶液与浓盐酸可发生氧化还原反应,但实验i中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。①方案一:取5mL浓盐酸,向其中加入15滴
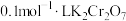 溶液,一段时间后,溶液变为绿色(
溶液,一段时间后,溶液变为绿色( 水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式
水溶液呈绿色),有黄绿色气体生成。写出发生反应的化学方程式②请你设计方案二:
您最近一年使用:0次
3 . 用K2Cr2O7溶液进行下列实验,结合实验,下列说法错误的是
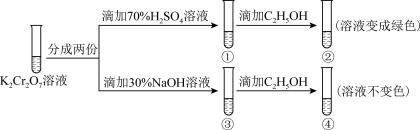
| A.①中溶液橙色加深,③中溶液变黄 |
B.②中 被C2H5OH还原 被C2H5OH还原 |
| C.K2Cr2O7的氧化性强于K2CrO4 |
| D.若向④中加入70%H2SO4溶液至过量,溶液恢复橙色 |
您最近一年使用:0次
4 . 汽车尾气在稀土催化剂作用下通过反应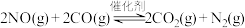 能实现转化。下列说法正确的是
能实现转化。下列说法正确的是
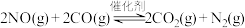 能实现转化。下列说法正确的是
能实现转化。下列说法正确的是A.该反应 |
B.该反应的平衡常数可表示为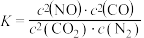 |
C.其它条件相同, 越大,CO的平衡转化率越大 越大,CO的平衡转化率越大 |
| D.若反应在恒温体积固定的条件下进行,平衡后充入氦气,压强增大,平衡正向移动 |
您最近一年使用:0次
名校
解题方法
5 . 金属铂(Pt)对气体(特别是H2、O2和CO)具有较强的吸附能力。因此常用来做电极材料,从某废旧电极材料(主要含有Pt、C、Al2O3、MgO)中回收Pt的一种工艺流程如图所示。
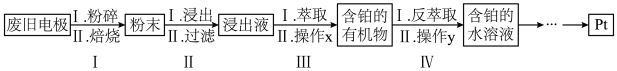
回答下列问题:
(1)过程Ⅰ中“焙烧”之前将废旧电极“粉碎”的目的是___________ 。
(2)实验人员采用三种不同的浸出液分别研究过程Ⅱ中Pt的浸出率。所用浸出液甲、乙、丙分别是HCl-H2SO4-NaClO3、HCI-NaClO3和HCl-H2O2。
①将浸出液为乙时的离子方程式补充完整:_____________
3Pt+___________Cl-+___________ +___________=3[PtCl6]2-+___________H2O
+___________=3[PtCl6]2-+___________H2O
②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=___________ 。
③c(H+)相同、浸出时间相同时,甲、乙、丙三种浸出液对Pt的浸出率如下表。[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
a.以HCl-NaClO3为例,说明当其中氧化剂浓度大于0.2mol/L时,Pt的浸出率降低的原因:随着c(NaClO3)增大,其氧化性增强,部分 被
被___________ 还原而消耗。
b.氧化剂浓度均为0.2mol/L时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)过程Ⅲ中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
ⅰ.R3N(O)+ +
+
 R3NHCl(O)。
R3NHCl(O)。
ⅱ.2R3NHCl(O)+
 (R3NH)2[PtCl6](O)+2
(R3NH)2[PtCl6](O)+2
①分离操作x是___________ 。
②“反萃取”时向含Pt的有机物中加入NaOH溶液,可使[PtCl6]2-进入水溶液体系,反应的离子方程式是___________ 。

回答下列问题:
(1)过程Ⅰ中“焙烧”之前将废旧电极“粉碎”的目的是
(2)实验人员采用三种不同的浸出液分别研究过程Ⅱ中Pt的浸出率。所用浸出液甲、乙、丙分别是HCl-H2SO4-NaClO3、HCI-NaClO3和HCl-H2O2。
①将浸出液为乙时的离子方程式补充完整:
3Pt+___________Cl-+___________
 +___________=3[PtCl6]2-+___________H2O
+___________=3[PtCl6]2-+___________H2O②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=
③c(H+)相同、浸出时间相同时,甲、乙、丙三种浸出液对Pt的浸出率如下表。[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
| 编号 | 氧化剂浓度/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 |
| 甲 | HCl-H2SO4-NaClO3对Pt的浸出率/% | 72.7 | 78.2 | 77.5 | 75.4 |
| 乙 | HCl-NaClO3对Pt的浸出率/% | 79.6 | 85.3. | 82.1 | 81.6. |
| 丙 | HCl-H2O2对Pt的浸出率/% | 80.0 | 85.6. | 83.2 | 82.5 |
 被
被b.氧化剂浓度均为0.2mol/L时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)过程Ⅲ中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
ⅰ.R3N(O)+
 +
+
 R3NHCl(O)。
R3NHCl(O)。ⅱ.2R3NHCl(O)+

 (R3NH)2[PtCl6](O)+2
(R3NH)2[PtCl6](O)+2
①分离操作x是
②“反萃取”时向含Pt的有机物中加入NaOH溶液,可使[PtCl6]2-进入水溶液体系,反应的离子方程式是
您最近一年使用:0次
名校
解题方法
6 . 下列解释事实的离子方程式不正确的是
A.NH4Cl溶于D2O使溶液显酸性: NH + D2O + D2O NH3•D2O +H+ NH3•D2O +H+ |
| B.CuSO4溶液中通入H2S气体生成黑色沉淀:Cu2+ +H2S=CuS↓+2H+ |
C.向AgCl的悬浊液中滴入Na2S溶液,浊液变黑:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq) Ag2S(s)+2Cl-(aq) |
D.向Na2CrO4溶液中滴加浓硫酸,溶液变为橙色:2CrO +2H+ +2H+  Cr2O Cr2O +H2O +H2O |
您最近一年使用:0次
名校
7 . CO可用于合成甲醇,反应的化学方程式为
 ,在密闭容器中充入一定量的CO和
,在密闭容器中充入一定量的CO和 ,在不同温度和压强下,CO的平衡转化率a如图所示。下列说法正确的
,在不同温度和压强下,CO的平衡转化率a如图所示。下列说法正确的
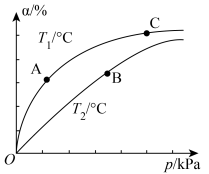

 ,在密闭容器中充入一定量的CO和
,在密闭容器中充入一定量的CO和 ,在不同温度和压强下,CO的平衡转化率a如图所示。下列说法正确的
,在不同温度和压强下,CO的平衡转化率a如图所示。下列说法正确的
A.温度: |
| B.增大体系压强,平衡向右移动,化学平衡常数K增大 |
C. |
D.A、B、C三点的平衡常数关系为 |
您最近一年使用:0次
2023-12-18更新
|
130次组卷
|
2卷引用:陕西省学林高中系列联考2023-2024学年高二上学期11月期中化学试题
名校
解题方法
8 . 某课外活动小组为了探究外界条件对化学平衡的影响,做了如下实验:
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比: (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入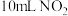 气体,将针筒前端封闭。
气体,将针筒前端封闭。

①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是___________ ;
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是___________ 。
(2)探究浓度对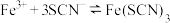 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
①甲同学根据中学所掌握知识预测红色应该___________ (填“变深”“变浅”或“不变”)。
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中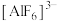 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该___________ (填“变深”“变浅”或“不变”),理由:___________ 。
(1)已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比:
 (式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入
(式中k为常数)。在a、b两支容积均为30mL的针筒中分别抽入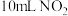 气体,将针筒前端封闭。
气体,将针筒前端封闭。
①将a针筒活塞迅速推至5mL处,从视线1处观察到的现象是
②将b针筒活塞迅速拉至20mL处,从视线2处观察到的现象是
(2)探究浓度对
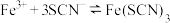 平衡的影响。将
平衡的影响。将 溶液(接近无色)和
溶液(接近无色)和 溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。
溶液等体积混合,将得到的红色溶液分为两等份。甲、乙两同学分别取一份向其中加入少量KCl(s)。①甲同学根据中学所掌握知识预测红色应该
②乙同学查阅资料得知该反应为配位反应,且学习到更多配离子,如冰晶石中
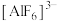 、银氨溶液中
、银氨溶液中 、
、 、
、 等。因此预测红色应该
等。因此预测红色应该
您最近一年使用:0次
2023-10-12更新
|
120次组卷
|
3卷引用:陕西省西安市鄠邑区2023-2024学年高二上学期期中质量检测化学试题
名校
9 . 工业上冶炼钙的原理如下。方法1:电解法。电解熔融 制备钙。方法2:铝热法。铝与氧化钙在高温、真空条件下反应生成钙蒸气,收集、冷凝得到钙,如
制备钙。方法2:铝热法。铝与氧化钙在高温、真空条件下反应生成钙蒸气,收集、冷凝得到钙,如 。已知部分物质的熔点和沸点如表所示:
。已知部分物质的熔点和沸点如表所示:
下列说法错误的是
 制备钙。方法2:铝热法。铝与氧化钙在高温、真空条件下反应生成钙蒸气,收集、冷凝得到钙,如
制备钙。方法2:铝热法。铝与氧化钙在高温、真空条件下反应生成钙蒸气,收集、冷凝得到钙,如 。已知部分物质的熔点和沸点如表所示:
。已知部分物质的熔点和沸点如表所示:| 物质 |  | CaO |  |  | Al | Ca |
| 熔点/℃ | 2054 | 2580 | 194 | 782 | 660 | 842 |
| 沸点/℃ | 2980 | 2850 | 178 | 1600 | 2467 | 1484 |
A.方法1的阴极产物为 |
B.方法2保持“真空”条件,避免钙与 等物质反应 等物质反应 |
| C.工业上用方法1的副产物可制备盐酸、漂粉精等 |
| D.用平衡移动原理可以解释方法2的化学原理 |
您最近一年使用:0次
2023-09-06更新
|
39次组卷
|
2卷引用:陕西省商洛市部分学校联考2023-2024学年高三上学期10月月考化学试题
名校
10 . 下列事实不能用勒夏特列原理解释的是
| A.新制氯水光照后颜色变浅 |
| B.氢气与碘蒸气反应的平衡混合气,经压缩后颜色变深 |
| C.工业合成氨,反应条件选择高压 |
| D.饮用汽水后常常出现“打嗝”现象 |
您最近一年使用:0次
2023-08-09更新
|
308次组卷
|
6卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期中考试化学试题



