名校
1 . 以CuZnOAl2O3作催化剂发生反应2CH3CHO(g)+H2O(g) C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是
C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是
 C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是
C2H5OH(g)+CH3COOH(g) ΔH<0,下列说法正确的是A.该反应的平衡常数K=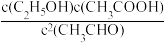 |
| B.反应物的键能总和小于生成物的键能总和 |
| C.该反应中每消耗1 mol H2O(g),转移电子数约为6.02×1023 |
| D.将C2H5OH移出一段时间后,v正增大 |
您最近一年使用:0次
2024-04-26更新
|
244次组卷
|
3卷引用:江苏省连云港高级中学2023-2024学年高三下学期4月期中考试化学试题
名校
2 . Ⅰ.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
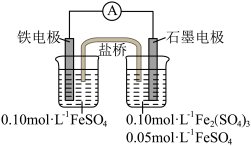
回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和________ (写名称)。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为________ ,因此,验证了Fe2+氧化性小于________ (写化学符号,下同)
Ⅱ.工业废水中常含有一定量有毒的Cr2O ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。
方法一:还原沉淀法
该法的工艺流程为:CrO Cr2O
Cr2O
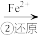 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
(3)第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显________ 色。
(4)写出第②步的离子反应方程式:________ 。
方法二:电解法
该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为________ 。

回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为
Ⅱ.工业废水中常含有一定量有毒的Cr2O
 ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。方法一:还原沉淀法
该法的工艺流程为:CrO
 Cr2O
Cr2O
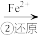 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(3)第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显(4)写出第②步的离子反应方程式:
方法二:电解法
该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。(5)用Fe做电极的原因为
您最近一年使用:0次
3 . 下列实验操作可以达到实验目的的是
| 选项 | 实验目的 | 实验操作及现象 |
| A | 比较CH3COOH和H2CO3的酸性 | 用pH计分别测定0.1000mol/LCH3COONH4溶液和Na2CO3溶液的pH后者大于前者 |
| B | 检验铁锈中含有二价铁 | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
| C | 探究氢离子浓度对 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸,观察到溶液由黄色变为橙红色 |
| D | 证明Cl2、Br2、I2的氧化性 | 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液,溶液先变橙色,后变蓝色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-28更新
|
106次组卷
|
3卷引用:江苏省连云港市2022-2023学年高二下学期6月期末考试化学试题
江苏省连云港市2022-2023学年高二下学期6月期末考试化学试题(已下线)专题02 化学实验基础-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)江苏省苏州市高新区第一中学2023-2024学年高二下学期5月月考化学试卷
解题方法
4 . 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 将铁锈溶于浓盐酸,滴入 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 检验铁锈中是否含有 |
| B | 向 溶液中缓慢滴加硫酸,观察溶液颜色变化 溶液中缓慢滴加硫酸,观察溶液颜色变化 | 探究 浓度对 浓度对 和 和 相互转化的影响 相互转化的影响 |
| C | 向NaBr溶液中滴加过量的氯水,再加入淀粉KI溶液,观察溶液颜色变化 | 比较 、 、 和 和 的氧化性强弱 的氧化性强弱 |
| D | 分别测定浓度均为 的 的 和 和 溶液的pH 溶液的pH | 比较 与 与 的水解常数大小 的水解常数大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 在一密闭容器中发生反应N2(g)+3H2(g) 2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
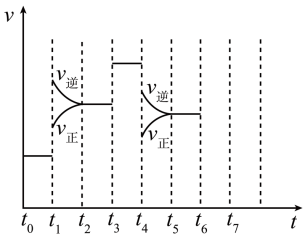
回答下列问题:
(1)判断t1、t3、t4时刻分别改变的一个条件。
A. 增大压强 B. 减小压强 C. 升高温度 D. 降低温度 E. 加催化剂 F. 充入氮气
t1时刻_______ (填标号,后同);t3时刻_______ ;t4时刻_______ 。
(2)依据(1)中的结论,下列时间段中,氨的百分含量最高的是_______(填标号)。
(3)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_______ 。
(4)工业上制取硝酸铵的流程图如下所示:
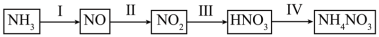
已知:4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) ΔH=-1745.2 kJ/mol
6NO(g)+4NH3(g)=5N2(g)+6H2O(g) ΔH=-1925.2 kJ/mol
则反应Ⅰ的热化学方程式可表示:_______
 2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
2NH3(g) ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)判断t1、t3、t4时刻分别改变的一个条件。
A. 增大压强 B. 减小压强 C. 升高温度 D. 降低温度 E. 加催化剂 F. 充入氮气
t1时刻
(2)依据(1)中的结论,下列时间段中,氨的百分含量最高的是_______(填标号)。
| A.t0~t1 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
(4)工业上制取硝酸铵的流程图如下所示:
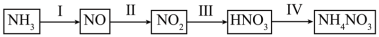
已知:4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) ΔH=-1745.2 kJ/mol
6NO(g)+4NH3(g)=5N2(g)+6H2O(g) ΔH=-1925.2 kJ/mol
则反应Ⅰ的热化学方程式可表示:
您最近一年使用:0次
6 . 对于反应2SO2(g)+ O2(g) 2SO3(g),下列有关说法
2SO3(g),下列有关说法正确 的是
 2SO3(g),下列有关说法
2SO3(g),下列有关说法| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.升高温度有利于提高SO2的平衡转化率 |
| C.使用 V2O5作催化剂,降低了反应的活化能,增大了单位体积内活化分子的数目 |
D.提高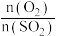 的值可增大O2的转化率 的值可增大O2的转化率 |
您最近一年使用:0次
2021-11-17更新
|
144次组卷
|
5卷引用:江苏省连云港市东海县石榴高级中学2023-2024学年高二上学期开学考试化学试题
解题方法
7 . 尿素[ ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是___________ 。
②合成尿素的化学方程式是___________ 。该反应属于___________ 反应(填“氧化还原”或“非氧化还原”)。
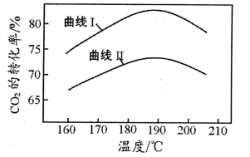
③合成中氨碳比[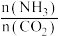 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为___________ ,反应最适宜温度为___________ 。
(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于___________ 晶体。
②尿素水解生成碳酸铵的化学方程式为___________ 。
 ]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
]是目前人类使用量最大的一种氮肥。工业上用氨气和二氧化碳为原料制取尿素。
(1)合成:氨气加压并预热后与压缩的二氧化碳在合成塔中反应生成尿素。
①氨气加压并预热的作用是
②合成尿素的化学方程式是
③合成中氨碳比[
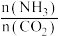 ]分别为3和4时,
]分别为3和4时, 的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为
的转化率随温度的变化如图所示。则图中曲线I对应的氨碳比为(2)分离:尿素水溶液经二段蒸发分离得到尿素。尿素水溶液在加热蒸发过程中会部分水解成碳酸铵或碳酸氢铵。
①尿素熔点132.7℃,沸点196.6℃,尿素晶体属于
②尿素水解生成碳酸铵的化学方程式为
您最近一年使用:0次
9-10高三·江苏连云港·阶段练习
8 . 在密闭容器中加入等浓度的CO与H2O,T℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
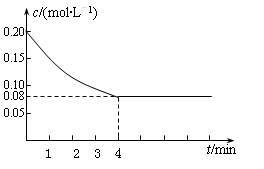
⑴从0~4 min,该反应的平均速率v(CO)=__________ mol/(L·min)。该反应的平衡常数为______________ 。
⑵为了增大CO的转化率,可以采取的措施有_________ 。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为______________ mol/L。
 CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
⑴从0~4 min,该反应的平均速率v(CO)=
⑵为了增大CO的转化率,可以采取的措施有
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为
您最近一年使用:0次



