名校
1 . 工业上利用天然气和水蒸气重整的方法制取合成气,相关反应如下: ,用E表示某种化学键的键能,CO分子中的化学键视为
,用E表示某种化学键的键能,CO分子中的化学键视为 。下列说法正确的是
。下列说法正确的是
 ,用E表示某种化学键的键能,CO分子中的化学键视为
,用E表示某种化学键的键能,CO分子中的化学键视为 。下列说法正确的是
。下列说法正确的是| A.该反应在任何温度下都能自发进行 |
B.该反应的 |
C.增大天然气与水蒸气的投料比,可提高 的平衡转化率 的平衡转化率 |
| D.使用催化剂可增大反应物中活化分子的百分数,加快反应速率 |
您最近一年使用:0次
名校
2 . 下列叙述不能用勒夏特列原理解释的是
| A.氯气在饱和食盐水中的溶解度比在水中小 |
| B.利用TiCl4水解制备TiO2时,需加入大量水并加热 |
| C.由H2、I2(g)和HI组成的平衡体系,加压后颜色变深 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置后溶液颜色变浅或褪去 |
您最近一年使用:0次
名校
3 . 以方铅矿(主要成分 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为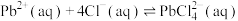
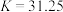
②
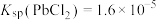
(1) 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为___________ ;“协同浸取”时加入 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是___________ 。
(2)“沉降分铅”的目的是将滤液中的 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数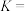
___________ 。
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是________ 。
(4)制备 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中,___________ ,真空40干燥得产品 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
 ,含少量
,含少量 )和软锰矿(主要成分
)和软锰矿(主要成分 )为原料制备电池材料
)为原料制备电池材料 和
和 ,过程可表示为
,过程可表示为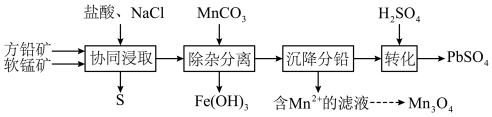
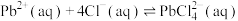
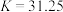
②

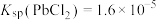
(1)
 时,“协同浸取”生成
时,“协同浸取”生成 和
和 的离子方程式为
的离子方程式为 可避免生成
可避免生成 沉积在矿石表面,其原因是
沉积在矿石表面,其原因是(2)“沉降分铅”的目的是将滤液中的
 沉降为
沉降为 沉淀。沉降反应
沉淀。沉降反应 的平衡常数
的平衡常数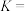
(3)络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与
 形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入
形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入 基团配位能力会增强,其原因分别是
基团配位能力会增强,其原因分别是(4)制备
 。
。 (难溶于水的黑色晶体)可通过空气氧化
(难溶于水的黑色晶体)可通过空气氧化 制得,制备时溶液的温度和
制得,制备时溶液的温度和 对
对 的产率影响如图所示。请补充完整由净化后的含
的产率影响如图所示。请补充完整由净化后的含 的滤液制备较纯净的
的滤液制备较纯净的 的实验方案:取一定量的含
的实验方案:取一定量的含 的滤液于三颈烧瓶中,
的滤液于三颈烧瓶中, 。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、
。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、 溶液。)
溶液。)
您最近一年使用:0次
2024-03-01更新
|
698次组卷
|
2卷引用:江苏省无锡市锡东高级中学2023-2024学年高三下学期4月月考化学试题
名校
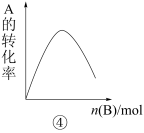
4 . 下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
 |  |
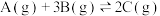 |  |
 |  |
 |  |
A.①是其他条件一定时,反应速率随温度变化的图像,则正反应 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像 |
您最近一年使用:0次
名校
5 . 二氧化硫制取三氧化硫的反应为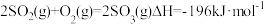 ,下列有关用二氧化硫制取三氧化硫的说法正确的是
,下列有关用二氧化硫制取三氧化硫的说法正确的是
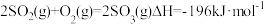 ,下列有关用二氧化硫制取三氧化硫的说法正确的是
,下列有关用二氧化硫制取三氧化硫的说法正确的是A.反应的 |
B.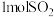 与足量 与足量 反应,放出的热量为 反应,放出的热量为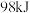 |
C.工业上用通入足量的空气来提高 的转化率 的转化率 |
D.反应中每消耗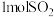 转移的电子数目约等于 转移的电子数目约等于 |
您最近一年使用:0次
2021-05-07更新
|
280次组卷
|
5卷引用:江苏省无锡市普通高中2021届高三下学期调研考试化学试题
名校
解题方法
6 . 实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol·L-1FeCl3溶液(接近无色)和0.01mol·L-1KSCN溶液等体积混合,得到红色溶液。
(1)FeCl3溶液呈酸性的原因是___ (用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中___ 增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
[查阅资料]
Fe3+和Cl-、SO 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。
实验I.探究现象a中溶液颜色变化的原因
(3)实验①的目的是___ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:___ 。
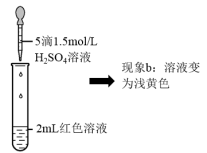
实验II.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是___ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:___ 、___ 。
(1)FeCl3溶液呈酸性的原因是
(2)甲同学认为加入酸后,会使Fe3++3SCN-⇌Fe(SCN)3体系中
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。
 |  |
Fe3+和Cl-、SO
 均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO
均能发生络合反应:Fe3++4Cl-⇌ [FeCl4]-(黄色);Fe3++2SO ⇌[Fe(SO4)2]-(无色)。
⇌[Fe(SO4)2]-(无色)。实验I.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
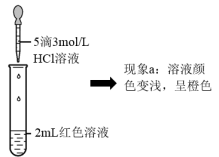
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol·L-1KCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验II.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
| ③ | 取1mL0.0025mol·L-1Fe2(SO4)3溶液(无色)。加入1mL0.01mol·L-1KSCN溶液,再加入5滴1.5mol·L-1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol·L-1FeCl3溶液, |
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
2021-04-01更新
|
558次组卷
|
9卷引用:江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题
江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题北京市海淀区2021届高三上学期期末考试化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)河北省石家庄市第二中学2021届高三3月学情考试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题北京市清华大学附属中学2022-2023学年高三上学期12月统练六化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)
名校
7 . I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)⇌ (aq),某I2、KI混合溶液中,
(aq),某I2、KI混合溶液中, 的物质的量浓度c(
的物质的量浓度c( )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
 (aq),某I2、KI混合溶液中,
(aq),某I2、KI混合溶液中, 的物质的量浓度c(
的物质的量浓度c( )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是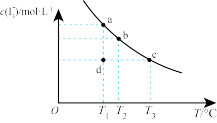
| A.温度为T1时,向该平衡体系中加入KI固体,平衡正同移动 |
B.I2(aq)+I-(aq)⇌ (aq)的△H<0 (aq)的△H<0 |
| C.若T1时,反应进行到状态d时,一定有v正>v逆 |
| D.状态a与状态b相比,状态b时I2的转化率更高 |
您最近一年使用:0次
2021-03-13更新
|
293次组卷
|
5卷引用:江苏省无锡市南菁高级中学实验班2023-2024学年高一下学期期中考试(化学)试卷
8 . 随着聚酯工业的快速发展,氯化氢的产出量迅速增长。将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的催化氧化法为:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
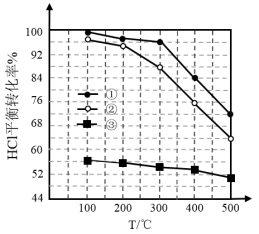
 2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
A.反应4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)的ΔH>0 2Cl2(g)+2H2O(g)的ΔH>0 |
| B.①对应的曲线表示的c(HCl)∶c(O2)=7∶1 |
C.300℃时,对于②表示的反应,若压缩容器的体积增大压强,则达到平衡时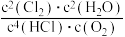 不变 不变 |
| D.对于③表示的反应,与100℃时相比,用更高效的催化剂在常温下反应不能改变HCl的平衡转化率 |
您最近一年使用:0次
2021-02-23更新
|
150次组卷
|
2卷引用:江苏省宜兴市张渚高级中学2020-2021学年高二下学期期中考试化学试题
名校
9 . 合成氨工艺是人工固氮最重要的途径,已知N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1,实际工业生产中,合成氨的原料气N2可通过分离空气得到,H2可通过天然气和水蒸气转化制得,原料气中N2和H2物质的量之比为1∶2.8,常用工艺条件:铁触媒作催化剂,控制温度773K、压强3.0×107Pa。氨的实际生产流程如图所示,下列说法不正确的是
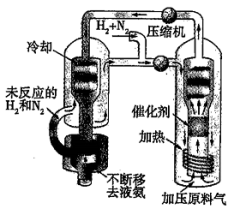

| A.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.增大相对廉价的N2在原料气中的比例以提高氢气的平衡转化率 |
| C.将NH3液化,并不断将液氨移去,利于反应正向进行 |
| D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生 |
您最近一年使用:0次
2021-02-03更新
|
168次组卷
|
2卷引用:江苏省无锡市太湖高级中学2021-2022学年高二下学期3月月考化学试题
名校
10 . 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A.CH3COOH CH3COO-+H+(忽略溶液体积变化) CH3COO-+H+(忽略溶液体积变化)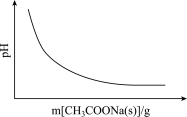 |
B.FeCl3+3KSCN Fe(SCN)3+3KCl(忽略溶液体积变化) Fe(SCN)3+3KCl(忽略溶液体积变化)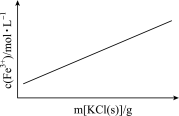 |
C.N2(g)+3H2(g)  2NH3(g)(恒温恒压) 2NH3(g)(恒温恒压) 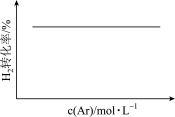 |
D.CH3OCH3(g)+3H2O(g)  6H2(g)+2CO2(g) △H>0(密闭容器,恒压) 6H2(g)+2CO2(g) △H>0(密闭容器,恒压)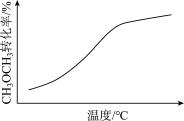 |
您最近一年使用:0次
2020-01-14更新
|
56次组卷
|
3卷引用:江苏省无锡市南菁高级中学实验班2023-2024学年高一下学期期中考试(化学)试卷



