1 . 历史上曾用Deacon法生产Cl2,化学原理为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下列说法正确的是
2Cl2(g)+2H2O(g)。下列说法正确的是
 2Cl2(g)+2H2O(g)。下列说法正确的是
2Cl2(g)+2H2O(g)。下列说法正确的是| A.该反应ΔH>0、ΔS>0 |
B.反应平衡常数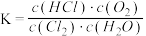 |
C.提高 的值可增大HCl的转化率 的值可增大HCl的转化率 |
| D.每生产1 mol Cl2,反应中转移电子数目约2×6.02×1023 |
您最近一年使用:0次
名校
2 . 已知CH4-CO2重整制氢的主要反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ: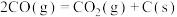

 下,将
下,将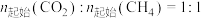 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:
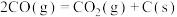

 下,将
下,将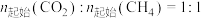 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是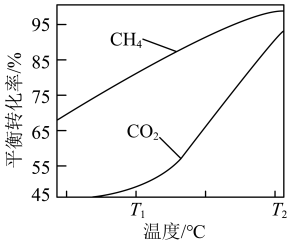
A.由图可知 |
| B.向重整体系中通入适量的H2O(g),不能减少C(s)的生成 |
| C.选择合适的催化剂可以提高T1时CH4的平衡转化率 |
D.相对 时, 时, 温度下 温度下 和 和 的转化率接近的主要原因是从 的转化率接近的主要原因是从 到 到 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 |
您最近一年使用:0次
名校
解题方法
3 . 一定温度下,在恒容的密闭容器内,将2molSO2和1molO2混合发生反应:2SO2(g)+O2(g) 2SO3(g) △H<0。回答下列问题:
2SO3(g) △H<0。回答下列问题:
(1)升高温度,混合气体的密度______ (填“变大”“变小”或“不变”)。
(2)若反应达到平衡后,再充入O2,平衡将______ (填“正向”“向”或“不”)移动,SO2的转化率______ (填“增大”“减小”或“不变”)。
(3)若反应达到平衡后,将c(SO2)、c(O2)、c(SO3)同时增大1倍,平衡将______ 移动。
(4)如图表示合成SO3反应在某段时间t0→t6中反应速率与时间的曲线图,t1、t3、t4时刻分别改变某一外界条件,它们依次为______ 、______ 、______ ;SO3的体积分数最小的平衡时间段是______ (填序号)。

 2SO3(g) △H<0。回答下列问题:
2SO3(g) △H<0。回答下列问题:(1)升高温度,混合气体的密度
(2)若反应达到平衡后,再充入O2,平衡将
(3)若反应达到平衡后,将c(SO2)、c(O2)、c(SO3)同时增大1倍,平衡将
(4)如图表示合成SO3反应在某段时间t0→t6中反应速率与时间的曲线图,t1、t3、t4时刻分别改变某一外界条件,它们依次为

您最近一年使用:0次
名校
解题方法
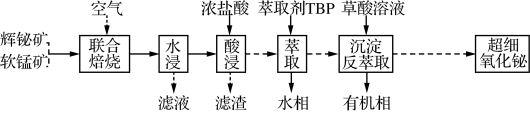
4 . 以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)和软锰矿(主要成分为MnO2)为原料制备超细氧化铋的工艺流程如图:
已知:Bi3+易与Cl-形成BiCl ,BiCl
,BiCl 易发生水解,其反应的离子方程式为BiCl
易发生水解,其反应的离子方程式为BiCl +H2O
+H2O BiOCl↓+5Cl-+2H+。
BiOCl↓+5Cl-+2H+。
(1)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4。该反应的化学方程式为_____ 。
(2)“酸浸”时需及时补充浓盐酸调节浸取液的pH。
①一般控制浸取液pH小于1.4,其目的是______ 。
②为提高酸浸时金属元素的浸出率,除适当增加浓盐酸用量、加快搅拌速度外,还可采取的措施有_____ 。
(3)铋离子能被有机萃取剂(简称TBP)萃取,其萃取原理可表示为BiCl (水层)+2TBP(有机层)
(水层)+2TBP(有机层) BiCl3•2TBP(有机层)+3Cl-(水层)。
BiCl3•2TBP(有机层)+3Cl-(水层)。
①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图1所示。c(Cl-)最佳为1.0mol•L-1的可能原因是______ 。

②萃取后分液所得水相中的主要阳离子为_____ (填化学式)。
(4)“沉淀反萃取”时生成草酸铋[Bi2(C2O4)3•7H2O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取”后有机相与草酸溶液的混合方式为_____ 。
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3•7H2O的质量的比值随温度变化的关系如图2所示。400℃时制得超细氧化铋,其化学式为_____ 。(写出计算过程,M[Bi2(C2O4)3•7H2O]=808g•mol-1)


已知:Bi3+易与Cl-形成BiCl
 ,BiCl
,BiCl 易发生水解,其反应的离子方程式为BiCl
易发生水解,其反应的离子方程式为BiCl +H2O
+H2O BiOCl↓+5Cl-+2H+。
BiOCl↓+5Cl-+2H+。(1)“联合焙烧”时,Bi2S3和MnO2在空气中反应生成Bi2O3和MnSO4。该反应的化学方程式为
(2)“酸浸”时需及时补充浓盐酸调节浸取液的pH。
①一般控制浸取液pH小于1.4,其目的是
②为提高酸浸时金属元素的浸出率,除适当增加浓盐酸用量、加快搅拌速度外,还可采取的措施有
(3)铋离子能被有机萃取剂(简称TBP)萃取,其萃取原理可表示为BiCl
 (水层)+2TBP(有机层)
(水层)+2TBP(有机层) BiCl3•2TBP(有机层)+3Cl-(水层)。
BiCl3•2TBP(有机层)+3Cl-(水层)。①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图1所示。c(Cl-)最佳为1.0mol•L-1的可能原因是

②萃取后分液所得水相中的主要阳离子为
(4)“沉淀反萃取”时生成草酸铋[Bi2(C2O4)3•7H2O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取”后有机相与草酸溶液的混合方式为
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi2(C2O4)3•7H2O的质量的比值随温度变化的关系如图2所示。400℃时制得超细氧化铋,其化学式为

您最近一年使用:0次
2023-03-14更新
|
587次组卷
|
3卷引用:江苏省盐城市五校2023届高三下学期3月联考化学试题
5 . 氯化亚铜的化学式CuCl或Cu2Cl2,为白色立方结晶或白色粉末。微溶于水,可溶于不同浓度的KCl溶液,生成[CuCl2]-、[CuCl3]2-和[CuCl4]3-等离子。例如:CuCl(s)+2Cl-(aq) [CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。对于反应CuCl(s)+2Cl-(aq)
[CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。对于反应CuCl(s)+2Cl-(aq) [CuCl3]2-(aq),下列说法正确的是
[CuCl3]2-(aq),下列说法正确的是
 [CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。对于反应CuCl(s)+2Cl-(aq)
[CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。对于反应CuCl(s)+2Cl-(aq) [CuCl3]2-(aq),下列说法正确的是
[CuCl3]2-(aq),下列说法正确的是| A.该反应的△H>0 |
B.该反应的平衡常数可表示为K=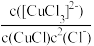 |
| C.加水可使该平衡向逆向移动 |
| D.其他条件相同,增大CuCl的量,可加快生成[CuCl3]2-的速率 |
您最近一年使用:0次
2022-02-20更新
|
376次组卷
|
2卷引用:江苏省盐城市五校2023届高三下学期3月联考化学试题
6 . 对于反应CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
 CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
CH4(g)+2H2O(g) ΔH<0。下列有关说法不正确的是| A.CH4既是氧化产物,又是还原产物 |
B.提高 的值可增大H2的转化率 的值可增大H2的转化率 |
| C.升高温度有利于提高CO2的平衡转化率 |
| D.提高CO2转化为CH4的转化率,需研发在低温区高效催化剂 |
您最近一年使用:0次
2021-11-12更新
|
327次组卷
|
5卷引用:江苏省盐城市2021-2022学年高三上学期期中考试化学试题
江苏省盐城市2021-2022学年高三上学期期中考试化学试题(已下线)第七单元 化学反应速率与化学平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)押江苏卷第8题 化学反应速率与化学平衡、热化学 -备战2022年高考化学临考题号押题(江苏卷)江苏省南京师范大学苏州实验学校2022-2023学年高二上学期9月月考化学试题(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
7 . 自然界中锰是含量较高的元素,分布在海洋深处与地壳中,它有多种化合价,如KMnO4(Ⅶ)、K2MnO4(Ⅵ)、MnO2(Ⅳ)等具有氧化性,MnSO4(Ⅱ)等具有还原性。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式___ 。
(2)某兴趣小组用KMnO4滴定法测定补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}中Fe2+含量进而计算产品中乳酸亚铁的质量分数。
①结果测得产品的质量分数总是大于100%,其原因可能是___ 。
②在滴定的时候发现,一开始反应很慢,一段时间后,反应速率迅速加快,产生该现象的原因可能是___ ;验证的实验方法是___ 。
(3)地下水中往往铁锰元素含量超标,常以Fe2+、Mn2+形式存在,可用ClO2水溶液去除铁、锰元素。随ClO2浓度、pH的增加,铁锰去除率或浓度变化曲线如图:
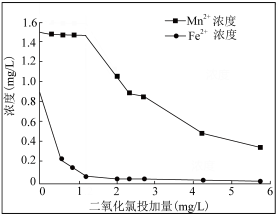
已知:1.碱性越大,Mn2+越易被氧化为MnO2,MnO2水合物可吸附Mn2+
2.ClO2易溶于水,不与水反应,消毒中常用作杀菌剂并转化为Cl-,碱性会歧化为ClO 和ClO
和ClO
①ClO2投加1.2mg前后,去除铁锰情况如图的原因是___ 。
②pH6~8锰去除率增大,其原因是___ 。
(1)工业上常用锰酸钾溶液电解制备高锰酸钾,写出离子方程式
(2)某兴趣小组用KMnO4滴定法测定补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}中Fe2+含量进而计算产品中乳酸亚铁的质量分数。
①结果测得产品的质量分数总是大于100%,其原因可能是
②在滴定的时候发现,一开始反应很慢,一段时间后,反应速率迅速加快,产生该现象的原因可能是
(3)地下水中往往铁锰元素含量超标,常以Fe2+、Mn2+形式存在,可用ClO2水溶液去除铁、锰元素。随ClO2浓度、pH的增加,铁锰去除率或浓度变化曲线如图:

已知:1.碱性越大,Mn2+越易被氧化为MnO2,MnO2水合物可吸附Mn2+
2.ClO2易溶于水,不与水反应,消毒中常用作杀菌剂并转化为Cl-,碱性会歧化为ClO
 和ClO
和ClO
①ClO2投加1.2mg前后,去除铁锰情况如图的原因是
②pH6~8锰去除率增大,其原因是

您最近一年使用:0次
2021-05-19更新
|
368次组卷
|
2卷引用:江苏省盐城市东台创新高级中学2021-2022学年高三10月份月检测化学试题
名校
8 . (铬是造成水体重度污染的元素之一,水体除铬主要有还原沉淀法、离子交换法、光催化还原法等。
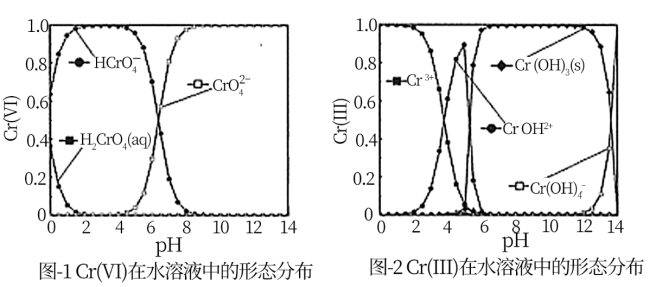
(1)还原沉淀法:向水体中加入FeSO4、CaSO3等将高毒性Cr(Ⅵ)还原为低毒性Cr(Ⅲ)再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
①Cr(Ⅵ)在水溶液中的存在形态分布如图1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4,发生的主要反应的离子方程式为___ 。
②Cr(Ⅲ)在水溶液中的存在形态分布如图2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为___ 。
(2)离子交换法:用强碱性离子交换树脂(ROH)与含铬离子(CrO 、HCrO
、HCrO 等)发生离子交换。如与CrO
等)发生离子交换。如与CrO 的交换可表示为2ROH(s)+CrO
的交换可表示为2ROH(s)+CrO (aq)
(aq) R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率与pH关系如图3所示,当pH>4时,Cr(Ⅵ)去除率下降的原因是
R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率与pH关系如图3所示,当pH>4时,Cr(Ⅵ)去除率下降的原因是___ 。
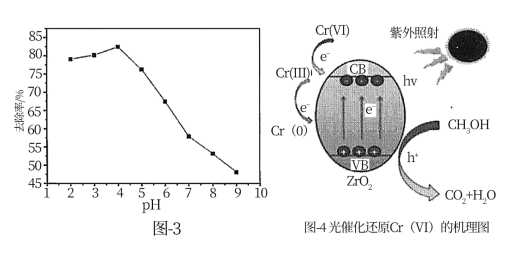
(3)光催化还原法:可能的反应机理如图4所示,ZrO2纳米管为催化剂,在紫外光照射下,VB端光生空穴(h+)被牺牲剂甲醇(CH3OH)消耗。在紫外光照射下,甲醇还原Cr(Ⅵ)的过程可描述为___ 。

(1)还原沉淀法:向水体中加入FeSO4、CaSO3等将高毒性Cr(Ⅵ)还原为低毒性Cr(Ⅲ)再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
①Cr(Ⅵ)在水溶液中的存在形态分布如图1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4,发生的主要反应的离子方程式为
②Cr(Ⅲ)在水溶液中的存在形态分布如图2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为
(2)离子交换法:用强碱性离子交换树脂(ROH)与含铬离子(CrO
 、HCrO
、HCrO 等)发生离子交换。如与CrO
等)发生离子交换。如与CrO 的交换可表示为2ROH(s)+CrO
的交换可表示为2ROH(s)+CrO (aq)
(aq) R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率与pH关系如图3所示,当pH>4时,Cr(Ⅵ)去除率下降的原因是
R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率与pH关系如图3所示,当pH>4时,Cr(Ⅵ)去除率下降的原因是
(3)光催化还原法:可能的反应机理如图4所示,ZrO2纳米管为催化剂,在紫外光照射下,VB端光生空穴(h+)被牺牲剂甲醇(CH3OH)消耗。在紫外光照射下,甲醇还原Cr(Ⅵ)的过程可描述为
您最近一年使用:0次
2021-05-16更新
|
448次组卷
|
3卷引用:江苏省盐城市2021届高三5月第三次模拟考试化学试题
名校
9 . 氰化氢(HCN,易挥发,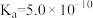 )主要应用于电镀、采矿、药物合成等工业生产。HCN、
)主要应用于电镀、采矿、药物合成等工业生产。HCN、 能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是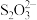 将
将 转化为
转化为 和
和 。验证该转化过程中生成
。验证该转化过程中生成 的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,_______ 。
(2)Cu2+可催化过氧化氢氧化废水中的 。
。
①反应不能在酸性条件下进行,原因是_______
②在含氰废水总量、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得 的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过
的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过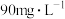 时,
时, 的氧化去除率有所下降,原因是
的氧化去除率有所下降,原因是_______ 。

(3)通过电激发产生 和
和 可处理废水中的
可处理废水中的 ,其可能的反应机理如图所示。
,其可能的反应机理如图所示。
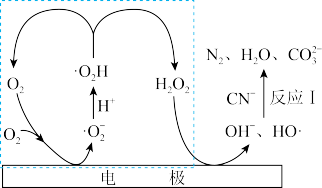
①反应I的离子方程式为_______ 。
②虚线方框内的过程可描述为_______ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应: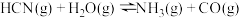

除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是_______ 。

 )主要应用于电镀、采矿、药物合成等工业生产。HCN、
)主要应用于电镀、采矿、药物合成等工业生产。HCN、 能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
能抑制人体组织细胞内酶的活性,不能直接排放到环境中。(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
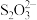 将
将 转化为
转化为 和
和 。验证该转化过程中生成
。验证该转化过程中生成 的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的
 。
。①反应不能在酸性条件下进行,原因是
②在含氰废水总量、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得
 的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过
的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过 时,
时, 的氧化去除率有所下降,原因是
的氧化去除率有所下降,原因是
(3)通过电激发产生
 和
和 可处理废水中的
可处理废水中的 ,其可能的反应机理如图所示。
,其可能的反应机理如图所示。
①反应I的离子方程式为
②虚线方框内的过程可描述为
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:
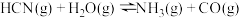

除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近一年使用:0次
2021-03-26更新
|
1193次组卷
|
6卷引用:江苏省盐城中学2022届高三第三次模拟考试化学试题
名校
10 . 下列叙述正确的是( )
| A.合成氨反应放热,采用低温可以提高氨的生成速率 |
| B.常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低 |
| C.反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0 |
D.在一容积可变的密闭容器中反应2SO2(g)+O2(g) 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动, 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,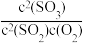 的值增大 的值增大 |
您最近一年使用:0次
2019-05-24更新
|
510次组卷
|
7卷引用:江苏省盐城市阜宁中学2020-2021学年高二下学期期中考试化学试题



