名校
解题方法
1 . 钒(V)被称为钢铁行业的“维生素”。从某钒矿石焙砂中提取钒的主要流程如下:

已知:
i.滤液A中的阳离子主要有H+、VO 、Fe3+、Al3+等;
、Fe3+、Al3+等;
ii.“萃取”过程可表示为VO2++2HA(有机相) VOA2(有机相)+2H+。
VOA2(有机相)+2H+。
(1)“浸钒”时,为加快浸出速率可采取的措施有___________ (写出1条即可)。
(2)“浸钒”过程中,焙砂中的V2O5与硫酸反应的离子方程式为___________ 。
(3)“还原”过程中,铁粉发生的反应有Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+和如下反应,补全该反应的离子方程式__________ 。
 VO
VO +
+ Fe+
Fe+ ___________=
___________= VO2++
VO2++ Fe2++
Fe2++ ___________
___________
(4)“萃取”前,若不用石灰乳先中和,萃取效果不好,原因是___________ 。
(5)写出“煅烧”过程发生反应的化学方程式___________ 。
(6)用以下方法测量“浸钒”过程中钒的浸出率。从滤液A中取出1mL,用蒸馏水稀释至
10mL,加入适量过硫酸铵,加热,将滤液A中可能存在的VO2+氧化为VO ,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO
,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO 滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
已知:a.所取钒矿石焙砂中钒元素的质量为ag;所得滤液A的总体积为bmL;
b.3滴指示剂消耗v2mL(NH4)2Fe(SO4)2溶液。
①用上述方法测得“浸钒”过程中钒的浸出率为___________ 。
②若不除去过量的过硫酸铵,钒浸出率的测定结果将___________ (填“偏高”“不变”或“偏低”)。

已知:
i.滤液A中的阳离子主要有H+、VO
 、Fe3+、Al3+等;
、Fe3+、Al3+等;ii.“萃取”过程可表示为VO2++2HA(有机相)
 VOA2(有机相)+2H+。
VOA2(有机相)+2H+。(1)“浸钒”时,为加快浸出速率可采取的措施有
(2)“浸钒”过程中,焙砂中的V2O5与硫酸反应的离子方程式为
(3)“还原”过程中,铁粉发生的反应有Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+和如下反应,补全该反应的离子方程式
 VO
VO +
+ Fe+
Fe+ ___________=
___________= VO2++
VO2++ Fe2++
Fe2++ ___________
___________(4)“萃取”前,若不用石灰乳先中和,萃取效果不好,原因是
(5)写出“煅烧”过程发生反应的化学方程式
(6)用以下方法测量“浸钒”过程中钒的浸出率。从滤液A中取出1mL,用蒸馏水稀释至
10mL,加入适量过硫酸铵,加热,将滤液A中可能存在的VO2+氧化为VO
 ,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO
,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO 滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。已知:a.所取钒矿石焙砂中钒元素的质量为ag;所得滤液A的总体积为bmL;
b.3滴指示剂消耗v2mL(NH4)2Fe(SO4)2溶液。
①用上述方法测得“浸钒”过程中钒的浸出率为
②若不除去过量的过硫酸铵,钒浸出率的测定结果将
您最近半年使用:0次
2023-11-06更新
|
339次组卷
|
4卷引用:北京市丰台区2023-2024学年高三上学期期中练习化学试题
名校
解题方法
2 . 海洋是生命的摇篮,蕴藏着丰富的化学资源。回答下列问题:
(1)粗盐中可溶性杂质离子包含Mg2+、Ca2+、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________
A.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
C.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
制取 晶体的“结晶”操作为
晶体的“结晶”操作为___________
(2)从海带中提取碘的实验过程如下图所示:
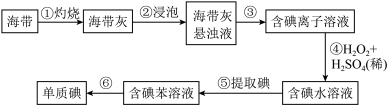
①灼烧海带时,应将海带放入___________ 中灼烧
A.烧杯 B.容量瓶 C.坩埚 D.锥形瓶
②请写出步骤④反应的离子方程式__________ 。
(3)海水显碱性,海水提溴过程中,先调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是___________ 。
(1)粗盐中可溶性杂质离子包含Mg2+、Ca2+、
 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为A.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
C.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
制取
 晶体的“结晶”操作为
晶体的“结晶”操作为(2)从海带中提取碘的实验过程如下图所示:

①灼烧海带时,应将海带放入
A.烧杯 B.容量瓶 C.坩埚 D.锥形瓶
②请写出步骤④反应的离子方程式
(3)海水显碱性,海水提溴过程中,先调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是
您最近半年使用:0次
解题方法
3 . 设 是阿伏加德罗常数的值,下列说法错误的是
是阿伏加德罗常数的值,下列说法错误的是
 是阿伏加德罗常数的值,下列说法错误的是
是阿伏加德罗常数的值,下列说法错误的是A.标准状况下,33.6 L HF中含有氟原子的数目为1.5 |
B.1 L   溶液中 溶液中 的数目小于0.1 的数目小于0.1 |
C.0.1 mol乙烯和乙醇的混合物完全燃烧消耗 的数目为0.3 的数目为0.3 |
D.电解精炼铜,当电路中通过 个电子时,阳极质量减少32 g 个电子时,阳极质量减少32 g |
您最近半年使用:0次
4 . 下列有关实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 分别向体积相同的两个密闭容器中通入2mol和4mol 气体,在相同温度下反应相同时间,比较两容器内气体颜色深浅 气体,在相同温度下反应相同时间,比较两容器内气体颜色深浅 | 探究压强对化学平衡移动的影响 |
| B | 向两支试管中分别加入2mL0.5mol/L 溶液,将其中一支试管加热,然后置于冷水中,观察并记录现象,与另一支试管进行比较 溶液,将其中一支试管加热,然后置于冷水中,观察并记录现象,与另一支试管进行比较 | 探究压强对化学平衡移动的影响 |
| C | 向滴有 的 的 溶液中加入少量 溶液中加入少量 固体,观察烧杯中溶液颜色变化 固体,观察烧杯中溶液颜色变化 | 探究压强对化学平衡移动的影响 |
| D | 分别向两支装有5mL0.5mol/L 溶液的试管中滴加5滴相同浓度的 溶液的试管中滴加5滴相同浓度的 溶液和 溶液和 溶液,比较两支试管产生气泡快慢 溶液,比较两支试管产生气泡快慢 | 探究 与 与 对 对 分解的催化效率 分解的催化效率 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
5 . 一种从含砷废水[砷主要以亚砷酸 形式存在]中回收砷的工艺流程如图所示。
形式存在]中回收砷的工艺流程如图所示。

已知:
Ⅰ. ;
;
Ⅱ.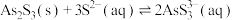 ;
;
Ⅲ.砷酸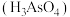 在酸性条件下有氧化性,能将氢硝酸氧化为
在酸性条件下有氧化性,能将氢硝酸氧化为 。
。
下列说法错误的是
 形式存在]中回收砷的工艺流程如图所示。
形式存在]中回收砷的工艺流程如图所示。
已知:
Ⅰ.
 ;
;Ⅱ.
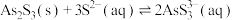 ;
;Ⅲ.砷酸
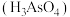 在酸性条件下有氧化性,能将氢硝酸氧化为
在酸性条件下有氧化性,能将氢硝酸氧化为 。
。下列说法错误的是
A.“滤渣”为 |
B.“沉砷”过程中 可以用过量的 可以用过量的 代替 代替 |
C.用氧气进行氧化脱硫生成 单质时发生反应 单质时发生反应 |
| D.能用氢碘酸、淀粉溶液检验还原后的溶液中是否仍存在砷酸 |
您最近半年使用:0次
名校
解题方法
6 . 用下列装置不能达到实验目的的是
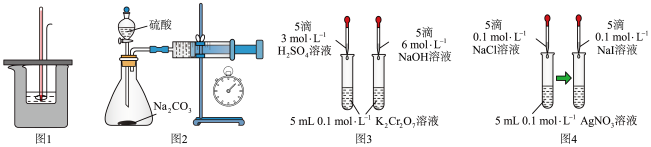

| A.图1:测量强酸强碱中和反应的反应热 |
B.图2:测定 和稀硫酸反应的速率 和稀硫酸反应的速率 |
| C.图3:验证浓度对化学平衡的影响 |
D.图4:证明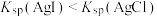 |
您最近半年使用:0次
2023-01-14更新
|
353次组卷
|
3卷引用:广东省佛山市2022~2023学年高二上学期期末考试化学试题
解题方法
7 . 工业上以铭铁矿(主要成分为 ,含有少量
,含有少量 )为原料制备金属铬的流程如图。下列说法错误的是
)为原料制备金属铬的流程如图。下列说法错误的是
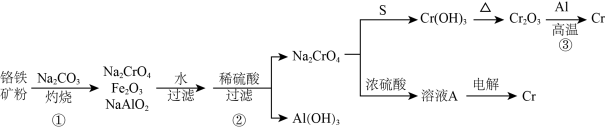
 ,含有少量
,含有少量 )为原料制备金属铬的流程如图。下列说法错误的是
)为原料制备金属铬的流程如图。下列说法错误的是
| A.反应①若在坩埚中进行,可以选择陶瓷坩埚 |
B.生成 的反应中氧化剂和还原剂的物质的量之比为2:1 的反应中氧化剂和还原剂的物质的量之比为2:1 |
C.加入浓硫酸发生反应的离子方程式: |
D.电解溶液 的阴极反应式: 的阴极反应式: |
您最近半年使用:0次
8 . 处理工业废水中 和
和 的工艺流程如下:
的工艺流程如下:

已知:(1)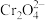 (黄色),
(黄色), (橙色)
(橙色)
(2)常温下, 的溶度积
的溶度积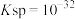
下列说法错误的是
 和
和 的工艺流程如下:
的工艺流程如下:
已知:(1)
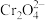 (黄色),
(黄色), (橙色)
(橙色)(2)常温下,
 的溶度积
的溶度积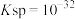
下列说法错误的是
A.第①步存在平衡: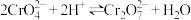 |
B.常温下,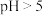 时 时 沉淀完全 沉淀完全 |
C.第②步能说明氧化性: |
D.稀释 溶液时,溶液中各离子浓度均减小 溶液时,溶液中各离子浓度均减小 |
您最近半年使用:0次
2022-01-21更新
|
368次组卷
|
4卷引用:湖南省长沙市2021-2022学年高三新高考适应性考试化学试题
湖南省长沙市2021-2022学年高三新高考适应性考试化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)福建省莆田第一中学2021-2022学年高二下学期期中考试化学试题(已下线)题型7 氧化还原反应原理在实际生产中的应用
名校
解题方法
9 . 含铬废水对环境污染严重,一种烟气协同处理含铬废水(含CrO 、Cr2O
、Cr2O 、泥沙等)的流程如图:
、泥沙等)的流程如图:
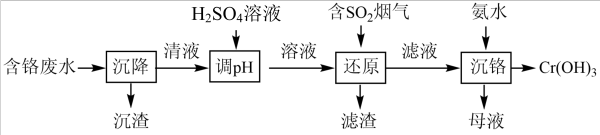
下列说法错误的是
 、Cr2O
、Cr2O 、泥沙等)的流程如图:
、泥沙等)的流程如图:
下列说法错误的是
| A.“沉降”的主要目的是除去泥沙等不溶物 |
B.“调pH”时存在CrO 转化为Cr2O 转化为Cr2O |
| C.H2SO4溶液更适合用盐酸代替 |
| D.母液经处理可获得(NH4)2SO4 |
您最近半年使用:0次
2021-03-13更新
|
297次组卷
|
2卷引用:河北省张家口市2021届高三第一次模拟考试化学试题
名校
10 . 苯的结构特点决定了苯容易发生取代反应,因此研究苯的取代产物及反应机理具有重要意义。
I.(1)苯与浓硫酸发生磺化反应生成苯磺酸,苯与浓硝酸和浓硫酸的混合物发生硝化反应生成硝基苯,磺化反应与硝化反应不同,是可逆反应。已知:H2SO4(浓硫酸)+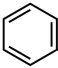

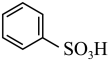 +H2O,要使反应向某一方向进行,需采用不同的条件,要使苯磺酸重新转变成苯和硫酸,需采用的条件是
+H2O,要使反应向某一方向进行,需采用不同的条件,要使苯磺酸重新转变成苯和硫酸,需采用的条件是___________________ (请写出两点)。
(2)苯的磺化反应的特点是反应中间体转变为苯磺酸与恢复为苯所越过的能垒差别不大(如图1所示)。
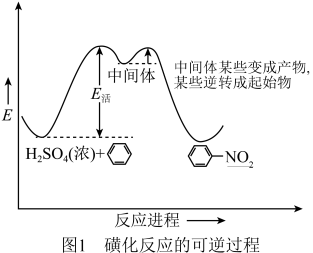

苯的硝化反应历程与苯的磺化反应部分相似,但中间体都转变成产物,反应是不可逆的,在图2上画出硝化反应的不可逆过程(表示出中间体的能量)______________ 。
(3)发烟硫酸与苯反应最快,在常温下即可与苯发生磺化反应,生成苯磺酸:H2SO4(发烟硫酸)+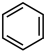

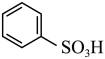 +H2O,当发烟硫酸和苯按1:1反应达到平衡后产生的苯磺酸的物质的量分数为26%,则该反应的平衡常数K为
+H2O,当发烟硫酸和苯按1:1反应达到平衡后产生的苯磺酸的物质的量分数为26%,则该反应的平衡常数K为___________ 。
Ⅱ.苯胺是苯的又一重要的取代产物,一步法合成苯胺的研究具有非常重要的现实意义。相关反应如下:
① (l)+NH3·H2O(l)
(l)+NH3·H2O(l)
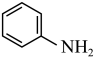 (l)+
(l)+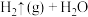 (1),反应①常温下不自发。
(1),反应①常温下不自发。
(1)反应①是放热反应还是吸热反应,判断并说明理由:_________ 。
(2)往反应①中加入 (l)后,所得反应(简称反应②,下同)在常温下能自发进行,原因是
(l)后,所得反应(简称反应②,下同)在常温下能自发进行,原因是_________ (已知反应①、②都是一步法合成苯胺的方法)。
(3)下列描述正确的是_________ 。
A.升高温度反应①的平衡常数增大
B.加压有利于反应①、②的平衡正向移动
C.反应①中加入 (1)后平衡正向移动
(1)后平衡正向移动
D.增大苯和一水合氨的配料比有利于提高苯胺的物质的量分数
I.(1)苯与浓硫酸发生磺化反应生成苯磺酸,苯与浓硝酸和浓硫酸的混合物发生硝化反应生成硝基苯,磺化反应与硝化反应不同,是可逆反应。已知:H2SO4(浓硫酸)+


 +H2O,要使反应向某一方向进行,需采用不同的条件,要使苯磺酸重新转变成苯和硫酸,需采用的条件是
+H2O,要使反应向某一方向进行,需采用不同的条件,要使苯磺酸重新转变成苯和硫酸,需采用的条件是(2)苯的磺化反应的特点是反应中间体转变为苯磺酸与恢复为苯所越过的能垒差别不大(如图1所示)。


苯的硝化反应历程与苯的磺化反应部分相似,但中间体都转变成产物,反应是不可逆的,在图2上画出硝化反应的不可逆过程(表示出中间体的能量)
(3)发烟硫酸与苯反应最快,在常温下即可与苯发生磺化反应,生成苯磺酸:H2SO4(发烟硫酸)+


 +H2O,当发烟硫酸和苯按1:1反应达到平衡后产生的苯磺酸的物质的量分数为26%,则该反应的平衡常数K为
+H2O,当发烟硫酸和苯按1:1反应达到平衡后产生的苯磺酸的物质的量分数为26%,则该反应的平衡常数K为Ⅱ.苯胺是苯的又一重要的取代产物,一步法合成苯胺的研究具有非常重要的现实意义。相关反应如下:
①
 (l)+NH3·H2O(l)
(l)+NH3·H2O(l)
 (l)+
(l)+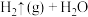 (1),反应①常温下不自发。
(1),反应①常温下不自发。(1)反应①是放热反应还是吸热反应,判断并说明理由:
(2)往反应①中加入
 (l)后,所得反应(简称反应②,下同)在常温下能自发进行,原因是
(l)后,所得反应(简称反应②,下同)在常温下能自发进行,原因是(3)下列描述正确的是
A.升高温度反应①的平衡常数增大
B.加压有利于反应①、②的平衡正向移动
C.反应①中加入
 (1)后平衡正向移动
(1)后平衡正向移动D.增大苯和一水合氨的配料比有利于提高苯胺的物质的量分数
您最近半年使用:0次
2020-12-17更新
|
158次组卷
|
2卷引用:浙江省普通高中强基联盟2021届高三上学期12月统测化学卷



