1 . 我国提出“CO2排放力争于2023年前达到峰值,努力争取2060年前实现碳中和”。研发CO2的利用技术,降低空气中CO2的含量是实现该目标的重要途径。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1
II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
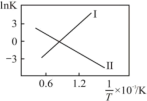
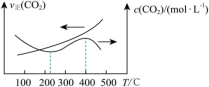
①反应I、II的lnK随1/T的变化如图所示,则ΔH2___________ 0(填“>”“<”或“=”)0;有利于反应I自发进行的温度是___________ (填“高温”或“低温”)。___________ ,而速率仍然增大的可能原因是___________ ___________ ,反应II的平衡常数Kp为___________ (保留两位有效数字)。[已知:CH4的选择性=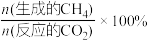 ]
]
(2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。___________ ,该化学链的总反应是___________ 。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2①反应I、II的lnK随1/T的变化如图所示,则ΔH2
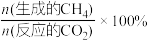 ]
](2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。

您最近一年使用:0次
2 . 应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
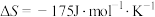 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
、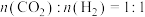 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。

 ,需通过以下两步实现:
,需通过以下两步实现:I.


II.


(1)反应过程中各物质的相对能量变化情况如图所示:

 =
=(2)若

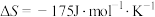 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应
 ,在540K下,按初始投料
,在540K下,按初始投料 、
、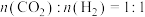 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:
②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
您最近一年使用:0次
解题方法
3 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
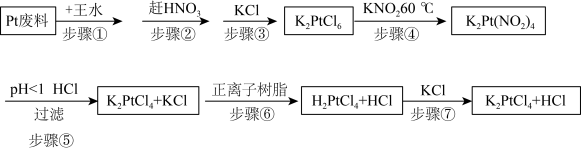
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近一年使用:0次
名校
解题方法
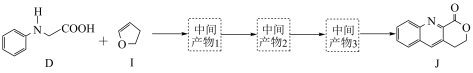
4 . 由 键构建
键构建 键是有机化学的热点研究领域。我国科学家利用
键是有机化学的热点研究领域。我国科学家利用 苯基甘氨酸中的
苯基甘氨酸中的 键在
键在 作用下构建
作用下构建 键,实现了喹啉并内酯的高选择性制备。合成路线如图。
键,实现了喹啉并内酯的高选择性制备。合成路线如图。
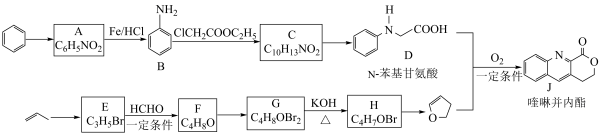
已知:i.
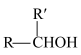
ii.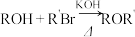
(1) 的反应类型是
的反应类型是___________ 。
(2)B具有碱性, 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,
的平衡转化率, 的作用是
的作用是___________ (写出一条即可)。
(3)C转化为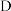 的化学方程式为
的化学方程式为___________ 。
(4) 转化为
转化为 的化学方程式为
的化学方程式为___________ ; 生成
生成 的过程中会得到少量的聚合物,写出其中一种的结构简式:
的过程中会得到少量的聚合物,写出其中一种的结构简式:___________ 。
(5)已知:
i.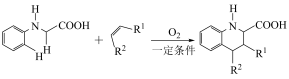
ii.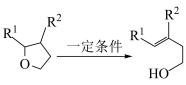
①D和 在
在 作用下得到
作用下得到 的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1___________ ,中间产物3___________ 。
②D和 转化成
转化成 的过程中还生成水,理论上该过程中消耗的
的过程中还生成水,理论上该过程中消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为___________ 。
 键构建
键构建 键是有机化学的热点研究领域。我国科学家利用
键是有机化学的热点研究领域。我国科学家利用 苯基甘氨酸中的
苯基甘氨酸中的 键在
键在 作用下构建
作用下构建 键,实现了喹啉并内酯的高选择性制备。合成路线如图。
键,实现了喹啉并内酯的高选择性制备。合成路线如图。
已知:i.

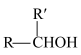
ii.
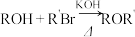
(1)
 的反应类型是
的反应类型是(2)B具有碱性,
 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,
的平衡转化率, 的作用是
的作用是(3)C转化为
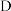 的化学方程式为
的化学方程式为(4)
 转化为
转化为 的化学方程式为
的化学方程式为 生成
生成 的过程中会得到少量的聚合物,写出其中一种的结构简式:
的过程中会得到少量的聚合物,写出其中一种的结构简式:(5)已知:
i.

ii.

①D和
 在
在 作用下得到
作用下得到 的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
的4步反应如图(无机试剂及条件已略去),中间产物1中有两个六元环和一个五元环,中间产物3中有三个六元环。结合已知反应信息,写出结构简式:中间产物1
②D和
 转化成
转化成 的过程中还生成水,理论上该过程中消耗的
的过程中还生成水,理论上该过程中消耗的 与生成的
与生成的 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
5 . 某学习小组欲利用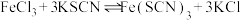 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变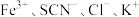 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴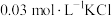 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
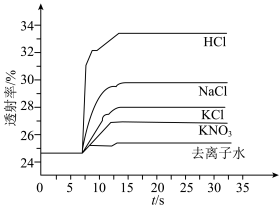
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
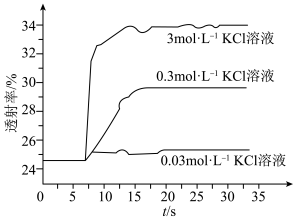
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②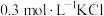 溶液、③
溶液、③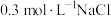 溶液、④
溶液、④ 溶液、⑤
溶液、⑤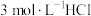 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
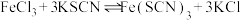 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
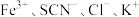 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②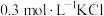 溶液、③
溶液、③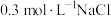 溶液、④
溶液、④ 溶液、⑤
溶液、⑤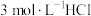 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近一年使用:0次
名校
解题方法
6 . 某废矿渣的主要成分有 、
、 、
、 、
、 ,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
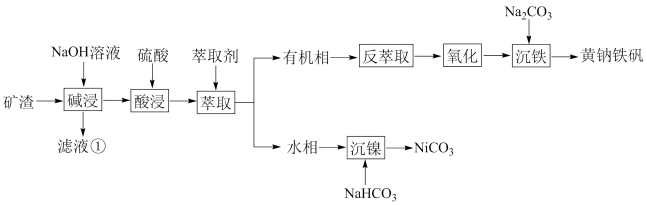
已知:i.黄钠铁矾 有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;
有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;
ii.常温下,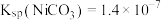 ;
;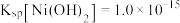 。
。
回答下列问题:
(1)滤液①中,主要存在的钠盐有_____________________ 。
(2)“萃取”可将金属离子进行富集与分离,原理如下:
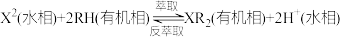 。
。
则“反萃取”应控制在____________________ (填“碱性”、“酸性”或“中性”)环境进行。
(3)“氧化”中加入 ,反应的氧化剂和还原剂的物质的量比为
,反应的氧化剂和还原剂的物质的量比为____________________ 。
(4)“沉镍”过程同时产生一种气体,该反应的离子方程式为_________________________ ,“沉镍”时若溶液 过大会导致
过大会导致 的产率下降,原因是
的产率下降,原因是__________________________ 。
(5)“沉铁”过程反应的离子方程式为_________________________ 。
(6)定量分析:
测定“酸漫”后的溶液中 的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液
的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液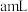 ,然后用
,然后用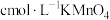 溶液滴定至终点,平行测定三次,平均消耗
溶液滴定至终点,平行测定三次,平均消耗 溶液
溶液 。则溶液中
。则溶液中 的物质的量浓度为
的物质的量浓度为___________  。
。
 、
、 、
、 、
、 ,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
已知:i.黄钠铁矾
 有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;
有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;ii.常温下,
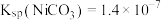 ;
;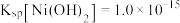 。
。回答下列问题:
(1)滤液①中,主要存在的钠盐有
(2)“萃取”可将金属离子进行富集与分离,原理如下:
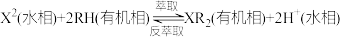 。
。则“反萃取”应控制在
(3)“氧化”中加入
 ,反应的氧化剂和还原剂的物质的量比为
,反应的氧化剂和还原剂的物质的量比为(4)“沉镍”过程同时产生一种气体,该反应的离子方程式为
 过大会导致
过大会导致 的产率下降,原因是
的产率下降,原因是(5)“沉铁”过程反应的离子方程式为
(6)定量分析:
测定“酸漫”后的溶液中
 的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液
的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液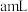 ,然后用
,然后用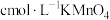 溶液滴定至终点,平行测定三次,平均消耗
溶液滴定至终点,平行测定三次,平均消耗 溶液
溶液 。则溶液中
。则溶液中 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
名校
7 . 氯化银的还原精炼技术是银回收精炼过程中的重要环节,有多种方法还原精炼。
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:___________ 。
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:___________ 。从N2H4发生的氧化反应(半反应)的角度分析加入氨水的作用___________ 。
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
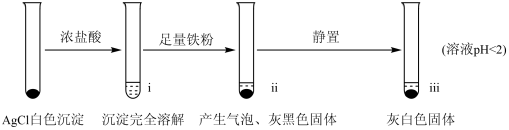
【资料】①AgCl+Cl- AgCl
AgCl
②Fe3++4Cl- FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,___________ (填现象),说明溶液中含有Fe2+。
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入___________ (填试剂)溶解,再加入NaCl溶液生成白色沉淀,证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:
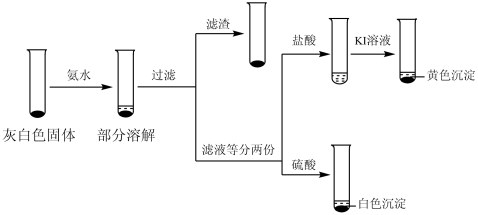
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:___________ 。
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
用离子方程式表示溶液变红的原因___________ ,Fe3++SCN- Fe(SCN)3。
Fe(SCN)3。
(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:___________ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:___________ 。
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:

【资料】①AgCl+Cl-
 AgCl
AgCl
②Fe3++4Cl-
 FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:

滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
 Fe(SCN)3。
Fe(SCN)3。(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
您最近一年使用:0次
真题
名校
8 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: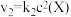 和
和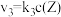 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: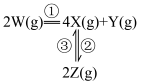
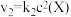 和
和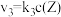 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
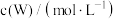 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.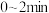 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若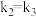 ,平衡时 ,平衡时 |
D.若升高温度,平衡时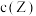 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
2934次组卷
|
4卷引用:2023年河北省高考化学试卷
解题方法
9 . 实验室以LiCoO2废渣为原料制备CoCO3,其部分实验过程如下。
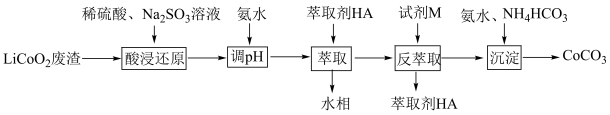
已知:Co2+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:2HA(有机层)+Co2+(水层) CoA2(有机层)+2H+(水层)
CoA2(有机层)+2H+(水层)
(1)为了提高酸浸过程中钴的浸出率,实验中可采取的措施有___________。(填字母)
(2)“酸浸还原”中,LiCoO2在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的化学方程式:___________ 。
(3)“反萃取”时加入试剂M,试剂M为___________ (填化学式),向有机相中加入试剂M溶液能进行反萃取的原因为___________ 。
(4)已知:常温下,Ksp[Co(OH)2]=2×10-15。若反萃取后的溶液中c(Co2+)=0.02mol•L-1,则“沉淀”过程需控制溶液pH的范围是___________ ,“沉淀”过程发生反应的离子方程式为___________ 。

已知:Co2+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:2HA(有机层)+Co2+(水层)
 CoA2(有机层)+2H+(水层)
CoA2(有机层)+2H+(水层)(1)为了提高酸浸过程中钴的浸出率,实验中可采取的措施有___________。(填字母)
| A.适当提高酸浸温度 | B.缩短酸浸时间 |
| C.增加LiCoO2废渣的投入量 | D.将LiCoO2废渣粉碎并适当加快搅拌 |
(2)“酸浸还原”中,LiCoO2在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的化学方程式:
(3)“反萃取”时加入试剂M,试剂M为
(4)已知:常温下,Ksp[Co(OH)2]=2×10-15。若反萃取后的溶液中c(Co2+)=0.02mol•L-1,则“沉淀”过程需控制溶液pH的范围是
您最近一年使用:0次
10 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有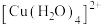 (蓝色)或
(蓝色)或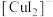 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
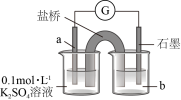
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
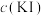 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
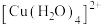 (蓝色)或
(蓝色)或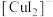 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
271次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题



