名校
解题方法
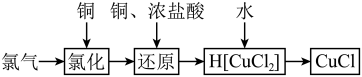
1 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向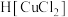 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
 的装置如图所示:
的装置如图所示: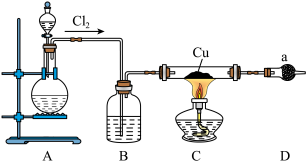
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
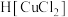 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
2024-06-06更新
|
55次组卷
|
2卷引用:2024届湘豫名校高三下学期考前保温卷理综试题-高中化学
解题方法
2 . 氯亚铂酸钾是合成绝大部分二价铂化合物的原料,广泛应用于电镀、医药中间体、催化剂前驱体等的制备。
已知:
利用Pt废料制备氯亚铂酸钾,流程如下:
(2)关于实验步骤说法错误的是___________。
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目___________ 。
(4)步骤⑦得到的溶液中含 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。
①蒸发浓缩需要控制温度75℃附近的原因___________ 。
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是___________ 。
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是___________ 。___________ 。
已知:
| 氯亚铂酸钾(K2PtCl4) | 水溶性可溶 10 g/L(20℃)、不溶于乙醇、受热分解。 |
| 氯铂酸钾(K2PtCl6) | 溶于热水、微溶于冷水、几乎不溶于乙醇、乙醚。 |
| 氯铂酸(H2PtCl6) | 110℃时部分分解,150℃开始生成金属铂。 |
| 亚硝酸钾(KNO2) | 有一定还原性,还原性:KNO2弱于K2C2O4。 |
| 亚硝酸(HNO2) | 弱酸、不稳定、易分解。 |
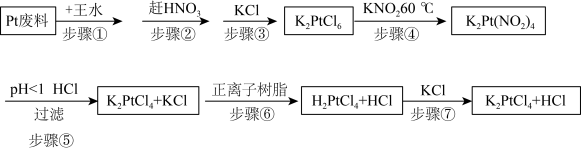
| A.步骤①中王水可以用浓硫酸代替 |
| B.步骤②利用硝酸的易挥发性,适合加强热 |
| C.步骤③加入KCl能促进K2PtCl6晶体析出 |
| D.步骤④用还原剂K2C2O4代替更好 |
(2)关于实验步骤说法错误的是___________。
| A.步骤⑤利用酸性条件下亚硝酸的不稳定性 |
B.步骤⑥用正离子树脂交换是指 和 和 的交换 的交换 |
| C.步骤⑦是氧化还原反应 |
| D.最后得到的溶液中经蒸发能除去HCl |
(3)步骤④发生时有红棕色气体生成,写出发生的化学反应方程式,并标出电子转移的方向和数目
(4)步骤⑦得到的溶液中含
 和HCl,为了进一步得到晶体
和HCl,为了进一步得到晶体 ,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾(
,需进一步蒸发浓缩(温度75℃附近)、冷却结晶、过滤、用乙醇洗涤、干燥得氯亚铂酸钾( )成品。
)成品。①蒸发浓缩需要控制温度75℃附近的原因
②洗涤操作中,用乙醇洗涤相比于用蒸馏水洗涤的优势是
A.减小固体的溶解损失
B.除去固体表面吸附的杂质
C.乙醇挥发带走水分,使固体快速干燥
③实验室进行以上步骤不需要用到的仪器是
A.  B.
B.  C.
C.  D.
D.
您最近一年使用:0次
真题
名校
3 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: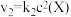 和
和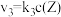 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: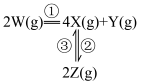
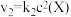 和
和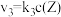 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
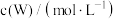 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.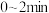 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若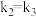 ,平衡时 ,平衡时 |
D.若升高温度,平衡时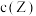 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
3330次组卷
|
5卷引用:2023年河北省高考化学试卷
解题方法
4 . 实验室以LiCoO2废渣为原料制备CoCO3,其部分实验过程如下。
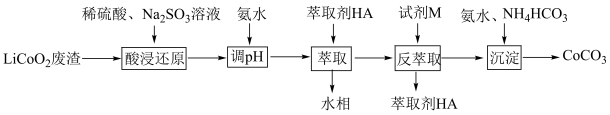
已知:Co2+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:2HA(有机层)+Co2+(水层) CoA2(有机层)+2H+(水层)
CoA2(有机层)+2H+(水层)
(1)为了提高酸浸过程中钴的浸出率,实验中可采取的措施有___________。(填字母)
(2)“酸浸还原”中,LiCoO2在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的化学方程式:___________ 。
(3)“反萃取”时加入试剂M,试剂M为___________ (填化学式),向有机相中加入试剂M溶液能进行反萃取的原因为___________ 。
(4)已知:常温下,Ksp[Co(OH)2]=2×10-15。若反萃取后的溶液中c(Co2+)=0.02mol•L-1,则“沉淀”过程需控制溶液pH的范围是___________ ,“沉淀”过程发生反应的离子方程式为___________ 。

已知:Co2+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:2HA(有机层)+Co2+(水层)
 CoA2(有机层)+2H+(水层)
CoA2(有机层)+2H+(水层)(1)为了提高酸浸过程中钴的浸出率,实验中可采取的措施有___________。(填字母)
| A.适当提高酸浸温度 | B.缩短酸浸时间 |
| C.增加LiCoO2废渣的投入量 | D.将LiCoO2废渣粉碎并适当加快搅拌 |
(2)“酸浸还原”中,LiCoO2在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的化学方程式:
(3)“反萃取”时加入试剂M,试剂M为
(4)已知:常温下,Ksp[Co(OH)2]=2×10-15。若反萃取后的溶液中c(Co2+)=0.02mol•L-1,则“沉淀”过程需控制溶液pH的范围是
您最近一年使用:0次
解题方法
5 . 某小组同学探究盐对Fe3+ +3SCN- Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响
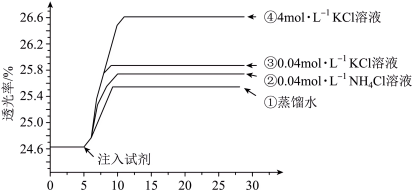
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1- [FeCl4]-(黄色);
[FeCl4]-(黄色);
ii.Fe3+与NO 不能形成配位化合物;
不能形成配位化合物;
iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要___________ ,用稀盐酸酸化FeCl3溶液的目的是___________ 。
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN- Fe(SCN)3平衡向
Fe(SCN)3平衡向___________ (填“正”或“逆”)反应方向移动。
(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因___________ 。
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是___________ 导致的(答出一种影响因素即可,不需详细说明理由)。
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为___________ (填离子符号),试分析该离子盐效应对Fe3+和SCN-平衡体系有影响的原因___________ 。
(6)拓展应用:盐效应对多种平衡体系有影响。
分析c(Na2SO4)在0~0.20 mol·L-1范围内,PbSO4溶解度发生变化的原因:___________ 。
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途___________ 。
 Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。实验I:探究KCl对Fe3+和SCN-平衡体系的影响
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1-
 [FeCl4]-(黄色);
[FeCl4]-(黄色);ii.Fe3+与NO
 不能形成配位化合物;
不能形成配位化合物;iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN-
 Fe(SCN)3平衡向
Fe(SCN)3平衡向(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
| 序号 | 加入试剂 | 溶液透光率 |
| 1 | 1 mL蒸馏水 | A1 |
| 2 | 1 mL 3 mol·L-1 KNO3 | A2 |
| 3 | 1 mL 3 mol·L-1 NaNO3 | A3 |
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为
(6)拓展应用:盐效应对多种平衡体系有影响。
| c(Na2SO4)/(mol·L-1) | 0 | 0.01 | 0.02 | 0.04 | 0.10 | 0.20 |
| PbSO4溶解度/mg | 4.5 | 0.48 | 0.42 | 0.39 | 0.48 | 0.69 |
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途
您最近一年使用:0次
名校
解题方法
6 . 我国冶铅工艺迅猛发展,底吹炉烟灰中除含有主金属铅外,还含有锌、镉(Cd)等有价金属元素,一种对该烟灰中有价金属综合回收工艺研究如下:

已知:Ⅰ.
①As元素以砷酸盐( )形式存在;
)形式存在;
②Pb元素主要以PbO和PbSO4形式存在,不溶于水;
③Cd元素主要以CdSO4形式存在,CdSO4易溶于水。
Ⅱ.水浸液初始pH=2~3;滤渣①返回冶铅系统;滤渣②主要成分为FeAsO4。
回答下列问题:
(1)为提高“水浸”效率,可以采取的措施有_______ (任写一条)。
(2)为提高铅和镉的回收率,需综合分析浸出率、渣含金属、渣率。
根据以上实验数据选择合适的液固比和温度:_______ ,理由:_______ 。
(3)“中和除砷”阶段主要反应的离子方程式为_______ 。该工序最终需加入试剂①调节溶液pH=5,下列最合适的是_______ (填序号)。
A.NaOH B.NH3·H2O C.Zn2O D.H2SO4
(4)“电解”过程中阴极的电极反应式为_______ 。

已知:Ⅰ.
| 底吹炉含镉烟灰的主要化学成分 |  |  |  |  |  |  |
| 质量分数/% | 37.40 | 15.88 | 2.51 | 0.15 | 0.28 | 0.15 |
 )形式存在;
)形式存在;②Pb元素主要以PbO和PbSO4形式存在,不溶于水;
③Cd元素主要以CdSO4形式存在,CdSO4易溶于水。
Ⅱ.水浸液初始pH=2~3;滤渣①返回冶铅系统;滤渣②主要成分为FeAsO4。
回答下列问题:
(1)为提高“水浸”效率,可以采取的措施有
(2)为提高铅和镉的回收率,需综合分析浸出率、渣含金属、渣率。
| 温度/℃ | 浸出率/% | 渣含金属 | 渣率/℃ | |||
 |  |  |  |  | ||
| 25 | 86.06 | 65.48 | 55.48 | 3.27 | 1.28 | 67.69 |
| 45 | 84.19 | 63.95 | 54.63 | 3.69 | 1.33 | 68.04 |
| 65 | 85.51 | 62.45 | 55.63 | 3.37 | 1.38 | 68.30 |
| 85 | 84.15 | 65.08 | 54.70 | 3.82 | 1.33 | 65.90 |
| 液固比 | 浸出率/% | 渣含金属 | 渣率/℃ | |||
 |  |  |  |  | ||
| 1:1 | 75.22 | 54.65 | 51.26 | 5.29 | 1.53 | 74.39 |
| 2:1 | 80.59 | 58.62 | 53.98 | 4.28 | 1.47 | 70.66 |
| 3:1 | 85.51 | 62.45 | 55.63 | 3.37 | 1.38 | 68.30 |
| 4:1 | 86.82 | 65.02 | 57.06 | 3.14 | 1.32 | 66.52 |
(3)“中和除砷”阶段主要反应的离子方程式为
A.NaOH B.NH3·H2O C.Zn2O D.H2SO4
(4)“电解”过程中阴极的电极反应式为
您最近一年使用:0次
7 . 铁的化合物在工业脱硫工艺中有着重要应用。
Ⅰ.电解脱硫
煤中的含硫物质主要是FeS2,电解脱硫原理如图。
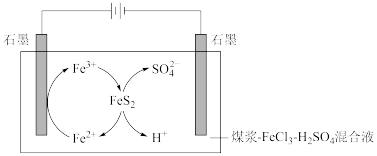
(1)阴极石墨棒上有无色气体产生,该气体是_______ (填化学式)。
(2)研究发现电解时若电压过高,阳极会有副反应发生,造成电解效率降低。某电压下电解100mL煤浆- FeCl3- H2SO4混合液,煤浆中除FeS2外无其它含硫物质, H2SO4浓度为0. 0lmol· L-1,当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c( )=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η(
)=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η( )=
)=_______ %[η(B)=  ]。
]。
(3)电解法脱硫的优点有_______ (写出一条即可)。
Ⅱ.生物脱硫
(4)Fe3+参与生物脱硫的过程分为吸收和再生两部分。
①吸收:Fe3+将工业废气中的H2S氧化为S
②再生:硫杆菌作用下O2氧化Fe2+再生Fe3+
硫杆菌生长的最佳pH范围是1. 4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
Ⅲ.络合脱硫
(5)碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,因此需将其制成可溶于水的配合物Fe(III)Ln(L表示配体,n表示配位数)。脱硫过程包含如下两步反应:
①碱性条件下,Fe(Ⅲ)Ln氧化H2S生成S8,离子方程式为_______ 。
②O2氧化再生Fe(Ⅲ)Ln,离子方程式为4Fe(Ⅱ)Ln+O2+2H2O=4Fe(Ⅲ)Ln +4OH-。脱硫过程总反应的化学方程式为_______ 。
(6)Na2H2Y (结构简式为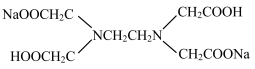 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是_______ 。
Ⅰ.电解脱硫
煤中的含硫物质主要是FeS2,电解脱硫原理如图。

(1)阴极石墨棒上有无色气体产生,该气体是
(2)研究发现电解时若电压过高,阳极会有副反应发生,造成电解效率降低。某电压下电解100mL煤浆- FeCl3- H2SO4混合液,煤浆中除FeS2外无其它含硫物质, H2SO4浓度为0. 0lmol· L-1,当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(
 )=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η(
)=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η( )=
)= ]。
]。(3)电解法脱硫的优点有
Ⅱ.生物脱硫
(4)Fe3+参与生物脱硫的过程分为吸收和再生两部分。
①吸收:Fe3+将工业废气中的H2S氧化为S
②再生:硫杆菌作用下O2氧化Fe2+再生Fe3+
硫杆菌生长的最佳pH范围是1. 4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
Ⅲ.络合脱硫
(5)碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,因此需将其制成可溶于水的配合物Fe(III)Ln(L表示配体,n表示配位数)。脱硫过程包含如下两步反应:
①碱性条件下,Fe(Ⅲ)Ln氧化H2S生成S8,离子方程式为
②O2氧化再生Fe(Ⅲ)Ln,离子方程式为4Fe(Ⅱ)Ln+O2+2H2O=4Fe(Ⅲ)Ln +4OH-。脱硫过程总反应的化学方程式为
(6)Na2H2Y (结构简式为
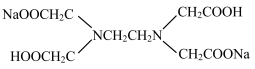 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
您最近一年使用:0次
名校
解题方法
8 . 研究碘在不同溶剂中的溶解性。进行实验:
①向试管中放入一小粒碘晶体,再加入蒸馏水,充分溶解后,得到黄色溶液a和少量不溶的碘;
②取5mL溶液a,加入 四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;
四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;
③将②所得下层溶液全部取出,加入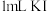 溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。
溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。
已知:ⅰ.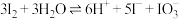 ;
;
ⅱ. 。
。
下列说法不正确 的是
①向试管中放入一小粒碘晶体,再加入蒸馏水,充分溶解后,得到黄色溶液a和少量不溶的碘;
②取5mL溶液a,加入
 四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;
四氯化碳,振荡,静置,液体分层,下层呈紫色,上层无色;③将②所得下层溶液全部取出,加入
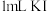 溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。
溶液,振荡,静置,下层溶液紫色变浅,上层溶液b呈黄色(颜色比溶液a深)。已知:ⅰ.
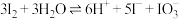 ;
;ⅱ.
 。
。下列说法
A. 是极性溶剂, 是极性溶剂, 是非极性溶剂,非极性的 是非极性溶剂,非极性的 更易溶于 更易溶于 |
| B.②中的下层溶液为碘的四氯化碳溶液 |
C.溶液b中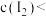 溶液a中 溶液a中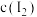 |
D.向①所得浊液中加入 ,使 ,使 增大,反应ⅰ平衡逆向移动,析出 增大,反应ⅰ平衡逆向移动,析出 |
您最近一年使用:0次
2023-01-06更新
|
758次组卷
|
4卷引用:北京市东城区2022-2023学年高三上学期1月期末统一检测化学试卷
9 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=___________ kJ/mol。
(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为___________ (保留2位有效数字)。
(4)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:

①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(5)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比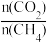 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:

随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=
(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
| A.增大CO2的浓度,有利于NH3的转化率增大 |
| B.反应在任何温度下都能自发进行 |
| C.当混合气体的密度不再发生改变时反应达平衡状态 |
| D.充入He,压强增大,平衡向正反应移动 |
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为
(4)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(5)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比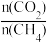 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近一年使用:0次
名校
解题方法
10 . 某温度下,改变0.1mol/LK2Cr2O7溶液的pH时,各种含铬元素微粒及OH-浓度变化如图所示(已知H2CrO4是二元酸),下列有关说法中正确的是


| A.该温度下的Kw=10-13 |
B.溶液中存在平衡 +H2O⇌2 +H2O⇌2 +2H+,该温度下此反应的K=10-13.2 +2H+,该温度下此反应的K=10-13.2 |
| C.向0.1mol/LK2Cr2O7溶液中加入一定量NaOH固体,溶液橙色加深 |
D.E点溶液中存在:c(K+)<2c( )+3c( )+3c( ) ) |
您最近一年使用:0次
2022-04-29更新
|
788次组卷
|
4卷引用:东北三省四城市联考暨沈阳市2021-2022学年高三质量监测(二)化学试题
东北三省四城市联考暨沈阳市2021-2022学年高三质量监测(二)化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)辽宁省沈阳市同泽中学2022-2023学年高二12月月考化学试题湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题



