1 . 应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
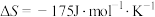 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
、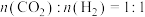 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。

 ,需通过以下两步实现:
,需通过以下两步实现:I.


II.


(1)反应过程中各物质的相对能量变化情况如图所示:

 =
=(2)若

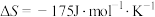 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应
 ,在540K下,按初始投料
,在540K下,按初始投料 、
、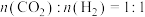 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:
②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
您最近一年使用:0次
2024·黑龙江·模拟预测
解题方法
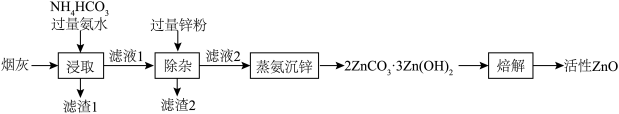
2 . 活性ZnO俗名锌白,用作白色颜料,也广泛用于生产玻璃、橡胶、油漆、塑料等。利用化工厂产生的烟灰(ZnO,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。
(1)Zn的基态价电子排布式为___________ ,烟灰中的主要成分ZnO发生反应的化学方程式为___________ ,滤渣1的主要成分为___________ 。
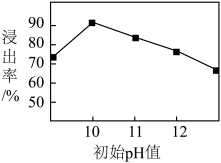
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是___________ 。 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式___________ 。
(4)“蒸氨”时会出现白色固体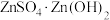 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率___________ (填“小于”、“大于”或“等于”)100%。
(6)已知 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。___________ (填化学式)。
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为___________ 。
(1)Zn的基态价电子排布式为
(2)锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大而减小的原因是
 也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式
也能与氨水形成配合物存在于浸出后的滤液中,加入Zn粉可将它置换除去,写出Zn粉和铜氨配合物反应的离子方程式(4)“蒸氨”时会出现白色固体
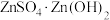 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)从m kg烟灰中得到活性ZnO akg,则ZnO的回收率
(6)已知
 和
和 的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌
的分解温度分别为125℃、300℃。实验室加热碱式碳酸锌 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。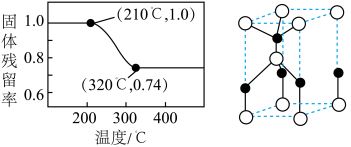
②经焙解得到的活性ZnO晶胞结构如图所示。该晶胞中Zn原子的配位数为
您最近一年使用:0次
2024·辽宁沈阳·一模
名校
3 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。
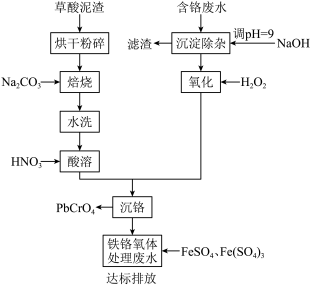

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近一年使用:0次
2024-04-13更新
|
265次组卷
|
4卷引用:东北三省四市2024届高三教研联合体高考模拟(一)化学试卷
东北三省四市2024届高三教研联合体高考模拟(一)化学试卷(已下线)东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题2024届江西省吉安市第一中学高三下学期一模化学试题
解题方法
4 . 根据实验操作及现象,得出结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A |  和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 | 硫酸表现氧化性, 表现还原性 表现还原性 |
| B | 向酸性 溶液中滴加乙苯,溶液褪色 溶液中滴加乙苯,溶液褪色 | 乙苯的苯环中含有碳碳双键 |
| C | Ag与HI溶液生成黄色沉淀和无色气体 |  和 和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 |
| D | 在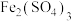 溶液中加入铜粉,溶液变蓝色 溶液中加入铜粉,溶液变蓝色 | 氧化性: , ,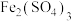 和Cu发生置换反应 和Cu发生置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与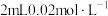 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与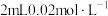 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。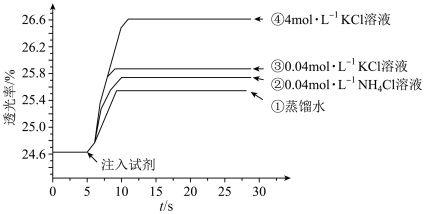
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试卷(二)
名校
6 . 硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。
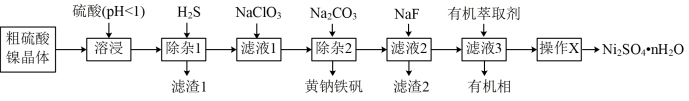
部分阳离子以硫化物的形式完全沉淀时溶液的pH见表。
回答下列问题:
(1)“溶浸”工序为了提高浸出率,可以采取的措施有____ 。(写出一条即可)
(2)“滤渣1”的主要成分为____ 。
(3)“滤液1”中加入NaClO3溶液,发生反应的离子方程式为____ 。
(4)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。已知CaF2与MgF2的Ksp分别为1.6×10-11、6.4×10-9,要使Ca2+和Mg2+均完全沉淀(离子浓度小于1×10-5mol/L),溶液中c(F-)须不低于____ mol/L。(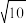 =3.16)
=3.16)
(5)“滤液3”中加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为;Zn2++4HA ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是
ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是____ 。

(6)将萃取后所得富含硫酸镍的溶液经操作X可得硫酸镍晶体,则操作X为____ 、____ ,过滤、洗涤等。
(7)NiSO4在强碱溶液中和NaClO反应,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为____ 。

部分阳离子以硫化物的形式完全沉淀时溶液的pH见表。
| 沉淀物 | CuS | ZnS | FeS | NiS |
| pH | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 |
(1)“溶浸”工序为了提高浸出率,可以采取的措施有
(2)“滤渣1”的主要成分为
(3)“滤液1”中加入NaClO3溶液,发生反应的离子方程式为
(4)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。已知CaF2与MgF2的Ksp分别为1.6×10-11、6.4×10-9,要使Ca2+和Mg2+均完全沉淀(离子浓度小于1×10-5mol/L),溶液中c(F-)须不低于
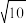 =3.16)
=3.16)(5)“滤液3”中加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为;Zn2++4HA
 ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是
ZnA2·2HA+2H+。已知加入萃取剂后,锌的萃取率随溶液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是
(6)将萃取后所得富含硫酸镍的溶液经操作X可得硫酸镍晶体,则操作X为
(7)NiSO4在强碱溶液中和NaClO反应,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为
您最近一年使用:0次



