名校
解题方法
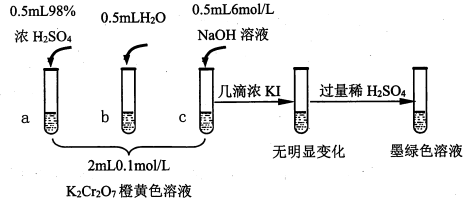
1 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?__________ (“是”或“否”),理由是____________________________________________________ 。
(3)对比试管a、b、c的实验现象,可知pH增大
_____ (选填“增大”,“减小”,“不变”);
(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________ CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________ 。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
①实验ⅱ中Cr2O72-放电的电极反应式是________________ 。
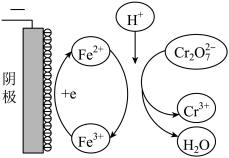
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________ 。

已知:Cr2O72-(橙色)+H2O
 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,可知pH增大

(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
| 实验 | ⅰ | ⅱ | ⅲ | ⅳ |
| 是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
| 是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
| 电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因

您最近一年使用:0次
名校
2 . 新制氢氧化铜存在平衡:Cu(OH)2 +2OH-⇌ (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验:
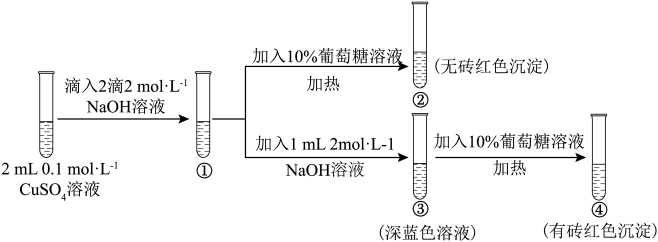
下列说法不正确 的是
 (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验:
下列说法
| A.①中出现蓝色沉淀 |
B.③中现象是Cu(OH)2 +2OH-⇌ 正向移动的结果 正向移动的结果 |
| C.④中现象证明葡萄糖具有还原性 |
D.对比②和④可知Cu(OH)2氧化性强于 |
您最近一年使用:0次
2017-02-17更新
|
752次组卷
|
10卷引用:【全国百强校】北京师范大学附属中学2017-2018学年高二下学期期中考试化学试题
【全国百强校】北京师范大学附属中学2017-2018学年高二下学期期中考试化学试题【全国百强校】北京101中学2017-2018学年高二下学期期中考试化学试题四川省双流中学2018-2019学年高二6月月考化学试题安徽省定远县育才学校2019-2020学年高二下学期期末考试化学试题(已下线)2.3.1 浓度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)湖南省常德市一中2020-2021学年高二上学期期末考试化学试题第四章 生物大分子2017届北京市海淀区高三上学期期末化学试卷北京市中央民族大学附属中学2022届高三9月月考化学试题(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
3 . Ⅰ.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
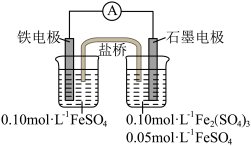
回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和________ (写名称)。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为________ ,因此,验证了Fe2+氧化性小于________ (写化学符号,下同)
Ⅱ.工业废水中常含有一定量有毒的Cr2O ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。
方法一:还原沉淀法
该法的工艺流程为:CrO Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
(3)第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显________ 色。
(4)写出第②步的离子反应方程式:________ 。
方法二:电解法
该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为________ 。

回答下列问题:
(1)实验室用FeSO4•7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为
Ⅱ.工业废水中常含有一定量有毒的Cr2O
 ,必须进行处理。常用的处理方法有两种。
,必须进行处理。常用的处理方法有两种。方法一:还原沉淀法
该法的工艺流程为:CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(3)第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显(4)写出第②步的离子反应方程式:
方法二:电解法
该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。(5)用Fe做电极的原因为
您最近一年使用:0次
4 . 下列实验操作可以达到实验目的的是
| 选项 | 实验目的 | 实验操作及现象 |
| A | 比较CH3COOH和H2CO3的酸性 | 用pH计分别测定0.1000mol/LCH3COONH4溶液和Na2CO3溶液的pH后者大于前者 |
| B | 检验铁锈中含有二价铁 | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
| C | 探究氢离子浓度对 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸,观察到溶液由黄色变为橙红色 |
| D | 证明Cl2、Br2、I2的氧化性 | 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液,溶液先变橙色,后变蓝色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 某化学小组研究草酸(H2C2O4)及其盐的性质。
(1)已知: ,
,
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是_______ 。
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是_______ (填字母)。
a.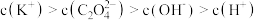
b.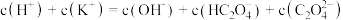
c.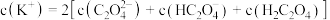
(2) 中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下,
中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下, 的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,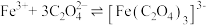 ,
,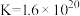 。
。
取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是_______ 。
(1)已知:
 ,
,
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是
a.
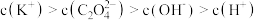
b.
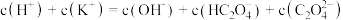
c.
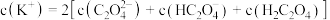
(2)
 中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下,
中碳元素的化合价是+3 价,推测其有还原性。文献表明:相同条件下, 的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于 Fe2+。为验证此结论,小组同学完成了如下实验:向10 mL0.5 mol·L−1FeCl3溶液中缓慢加入0.5mol·L−1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3·3H2O]为翠绿色晶体,
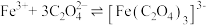 ,
,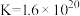 。
。取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是
您最近一年使用:0次
名校
解题方法
6 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: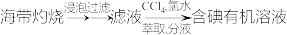

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
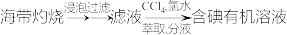

d.海水提溴:

您最近一年使用:0次
2022-11-11更新
|
174次组卷
|
2卷引用:湖北省黄冈市黄梅县育才高级中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
7 . 过氧化氢是一种常用的绿色试剂,某学习小组针对 性质进行如图实验。
性质进行如图实验。
Ⅰ.验证 的还原性
的还原性
查阅资料: 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。
(1)制取氯水
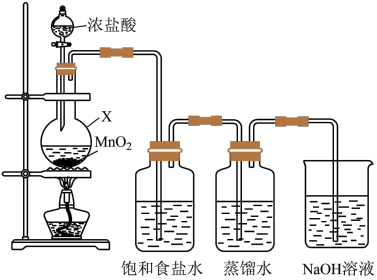
① 不溶于饱和食盐水的原因是
不溶于饱和食盐水的原因是________ (用平衡移动原理解释)。
②取5mL上述新制饱和氯水于试管中,向其中加入 溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是
溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是________ 。
Ⅱ.探究 、
、 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
(2)实验结果显示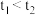 ,可得出的结论是:
,可得出的结论是:________ (填化学式)更有利于 分解。
分解。
(3)甲同学查阅资料得知: 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为________  的
的________ (填化学式)溶液和________ (填化学式)溶液。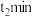 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。
(4)乙同学又提出猜想: 、
、 对
对 催化
催化 分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
A. 溶液,B.少量KCl固体,C.
溶液,B.少量KCl固体,C.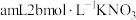 溶液,D.少量
溶液,D.少量 固体
固体
(5)根据实验1~4中测得的 完全分解所需时间,小组同学认为
完全分解所需时间,小组同学认为
________ (填“增强”或“减弱”,下同) 的催化效果,
的催化效果,
________  的催化效果。
的催化效果。
 性质进行如图实验。
性质进行如图实验。Ⅰ.验证
 的还原性
的还原性查阅资料:
 溶液与氯水发生反应时表现还原性。
溶液与氯水发生反应时表现还原性。(1)制取氯水

①
 不溶于饱和食盐水的原因是
不溶于饱和食盐水的原因是②取5mL上述新制饱和氯水于试管中,向其中加入
 溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是
溶液至过量,产生大量气泡(该气体可使余烬复燃),还观察到溶液颜色发生的变化是Ⅱ.探究
 、
、 对
对 分解的影响。记录数据如下:
分解的影响。记录数据如下:
| 实验序号 | 添加试剂及用量 |
|
1 |
|
| |
2 |
|
|
(2)实验结果显示
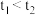 ,可得出的结论是:
,可得出的结论是: 分解。
分解。(3)甲同学查阅资料得知:
 能加速
能加速 分解,
分解, 对
对 分解无影响。为排除
分解无影响。为排除 干扰,该同学进行实验:向两份
干扰,该同学进行实验:向两份 溶液中分别加入amL浓度均为
溶液中分别加入amL浓度均为 的
的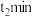 内,发现
内,发现 均几乎不分解。甲同学认为:在无
均几乎不分解。甲同学认为:在无 存在的情况下,
存在的情况下, 、
、 对
对 催化分解无影响。
催化分解无影响。(4)乙同学又提出猜想:
 、
、 对
对 催化
催化 分解会产生影响。于是进行如表实验。限选试剂及其标号如下:
分解会产生影响。于是进行如表实验。限选试剂及其标号如下:A.
 溶液,B.少量KCl固体,C.
溶液,B.少量KCl固体,C.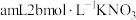 溶液,D.少量
溶液,D.少量 固体
固体
| 实验序号 | 添加试剂 |
|
3 | 需同时加入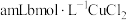 溶液和① 溶液和① |
| |
4 | 需同时加入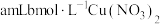 溶液和② 溶液和② |
|
(5)根据实验1~4中测得的
 完全分解所需时间,小组同学认为
完全分解所需时间,小组同学认为
 的催化效果,
的催化效果,
 的催化效果。
的催化效果。
您最近一年使用:0次
8 . 许多含氯化合物既是重要化工原料,又是高效、广谱灭菌消毒剂。
(1)亚氯酸钠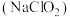 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
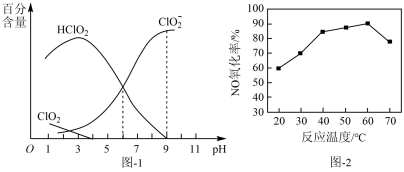
溶液中存在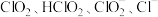 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
①25℃时,
_______  。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,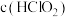
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②酸性条件下,NaClO2能将烟气中的NO氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
③温度高于60℃时,NO氧化率下降,其原因是_______ 。
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当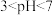 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是_______ 。
②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是_______ 。
(1)亚氯酸钠
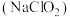 是一种高效漂白剂。在
是一种高效漂白剂。在 溶液中存在
溶液中存在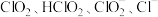 等微粒。经测定,25℃时各组分含量随
等微粒。经测定,25℃时各组分含量随 变化情况如题图-1所示(
变化情况如题图-1所示( 未画出)。其他条件相同时,以
未画出)。其他条件相同时,以 溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
溶液为吸收剂,测得相同时间内NO的氧化率随温度的变化情况如题图-2所示。
①25℃时,

 。25℃时,浓度均为
。25℃时,浓度均为 的HClO2溶液和
的HClO2溶液和 溶液等体积混合后,
溶液等体积混合后,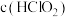
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②酸性条件下,NaClO2能将烟气中的NO氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③温度高于60℃时,NO氧化率下降,其原因是
(2)二氧化氯(ClO2)是一种广谱消毒剂。ClO2在酸性溶液中比较稳定,氧化性随着溶液酸性增强而增强;ClO2在碱性溶液中不能稳定存在,可歧化为NaClO3和NaClO2。以ClO2为吸收剂进行脱硫,实验时测得SO2的脱除率随溶液pH变化如题图-3所示。

①当
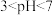 时,随pH的增大,SO2脱除率逐渐降低,其原因是
时,随pH的增大,SO2脱除率逐渐降低,其原因是②在pH约7.6之后,随pH的增大,SO2脱除率又开始升高,其原因是
您最近一年使用:0次
9 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____ (“是”或“否”),理由是_________________________________ 。
(3)对比试管a、b、c的实验现象,得到的结论是________________ 。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______ ;写出此过程中氧化还原反应的离子方程式________________ 。
(5)小组同学用电解法处理含Cr2O 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。
①实验ⅱ中Cr2O 放电的电极反应式是
放电的电极反应式是________________ 。
②实验ⅲ中Fe3+去除Cr2O 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因_______________ 。


已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,得到的结论是
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是
(5)小组同学用电解法处理含Cr2O
 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。| 实验 | ⅰ | ⅱ | ⅲ | ⅳ |
| 是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
| 是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
| 电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O 的去除率/% 的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
 放电的电极反应式是
放电的电极反应式是②实验ⅲ中Fe3+去除Cr2O
 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因
您最近一年使用:0次
2018-04-01更新
|
644次组卷
|
3卷引用:【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题
10 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+的正反应是
+2H+的正反应是_______ (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,那么加入KOH后,现象是_______ 。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的_______ (填“能”或“不能”),理由是_______ 。然后,根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强。
继续实验

(4)解释溶液变黄的主要原因是K2Cr2O7中存在平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+,加入Na2SO3溶液以后,
+2H+,加入Na2SO3溶液以后,_______ 离子可以和_______ 离子结合,平衡正向移动,溶液变为黄色。
(5)溶液变绿色,该反应的离子方程式是_______ 。
已知:①K2Cr2O7溶液存在平衡:Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+。
+2H+。②含铬元素的离子在溶液中的颜色:Cr2O
 (橙色);CrO
(橙色);CrO (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
(1)i可证明反应Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+的正反应是
+2H+的正反应是(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,那么加入KOH后,现象是
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的
继续实验

(4)解释溶液变黄的主要原因是K2Cr2O7中存在平衡:Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+,加入Na2SO3溶液以后,
+2H+,加入Na2SO3溶液以后,(5)溶液变绿色,该反应的离子方程式是
您最近一年使用:0次

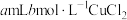 溶液
溶液
 溶液
溶液