名校
解题方法
1 . 表中实验操作、现象与结论对应关系均正确的
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取2mL0.lmol/LAgNO3溶液,先后滴加3滴0.lmol/LNaCl溶液和6滴0.lmol/LKI溶液,观察沉淀情况 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)大于Ksp(AgI) |
| B | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY弱 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测定pH=3.2 | NaHSO3溶液呈酸性,证明 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)>Ksp(CaCO3),实现沉淀的转化 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
3 . 氨气和甲醇都是重要的工业产品,试运用必要的化学原理解决有关问题。
(1)在密闭容器中,使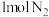 和
和 混合发生下列反应:
混合发生下列反应:
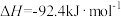 。
。
①反应进行一段时间后, 和
和 的转化率之比
的转化率之比______ 1(填“>”“<”或“=”)。
②当达到平衡时,充入氩气,并保持体积不变,平衡将______ (填“正向”“逆向”或“不”)移动。
③恒温下,压缩容器体积,混合气体的平均相对分子质量______ ,密度______ (填“变大”“变小”或“不变”)。
(2)水煤气在一定条件下可合成甲醇: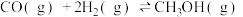
 。将1mol CO和
。将1mol CO和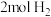 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
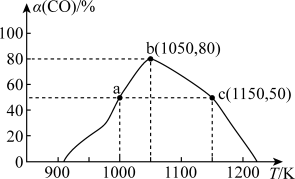
①试求温度为1000K条件下,反应开始至2min时,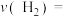
______ 。
②由图可知,从反应开始到b点之前,CO的转化率随温度升高而增大,原因是____________________ 。
③已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数 为
为______ (不用写单位, 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
(1)在密闭容器中,使
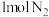 和
和 混合发生下列反应:
混合发生下列反应:
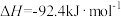 。
。①反应进行一段时间后,
 和
和 的转化率之比
的转化率之比②当达到平衡时,充入氩气,并保持体积不变,平衡将
③恒温下,压缩容器体积,混合气体的平均相对分子质量
(2)水煤气在一定条件下可合成甲醇:
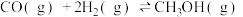
 。将1mol CO和
。将1mol CO和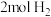 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,
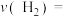
②由图可知,从反应开始到b点之前,CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数
 为
为 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
您最近半年使用:0次
4 . 钒具有广泛用途。黏土钒矿中,钒以 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
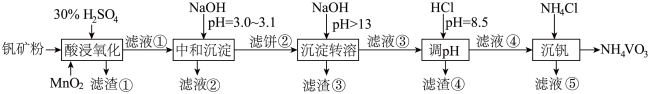
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”中, 和
和 被氧化成
被氧化成 ,同时还有
,同时还有_______ 离子被氧化。写出 转化为
转化为 反应的离子方程式
反应的离子方程式_______ 。
(2)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、_______ ,以及部分的_______ 。
(3)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是_______ 。
(4)利用上述表格数据,计算 的
的
_______ ( 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于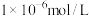 )。
)。
(5)“沉钒”中析出 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是_______ 。
 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.0 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”中,
 和
和 被氧化成
被氧化成 ,同时还有
,同时还有 转化为
转化为 反应的离子方程式
反应的离子方程式(2)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、(3)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(4)利用上述表格数据,计算
 的
的
 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于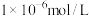 )。
)。(5)“沉钒”中析出
 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是
您最近半年使用:0次
名校
5 . 重铬酸钾(K2Cr2O7)又名红矾钾,是化学实验室中的一种重要分析试剂,在工业上用途广泛。已知K2Cr2O7溶液中存在平衡:
请回答下列问题:
(1)K2Cr2O7溶液中反应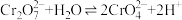 平衡常数的表达式为
平衡常数的表达式为
___________ 。
(2)复分解法制备重铬酸钾:以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是___________ 。
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7___________ K2Cr2O7(填“>”“<”或“=”)。
(3)K2Cr2O7溶液中存在的平衡又可分解为以下两步:
(ⅰ)

(ⅱ)

①下列有关K2Cr2O7溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时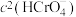 与
与 的比值保持不变
的比值保持不变
②在0.10 mol⋅L-1 K2Cr2O7溶液中设 、
、 、
、 的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为_______ =0.10。
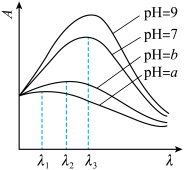
③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长(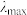 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与 的
的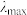 最接近的是
最接近的是_______ ;溶液pH从a变到b的过程中, 的值
的值_______ (填“增大”“减小”或“不变”)。

请回答下列问题:
(1)K2Cr2O7溶液中反应
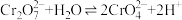 平衡常数的表达式为
平衡常数的表达式为
(2)复分解法制备重铬酸钾:以Na2CrO4溶液为原料,步骤如下:
①先向Na2CrO4溶液中加入酸调节溶液pH,其目的是
②再向①的溶液中加入适量KCl,搅拌溶解、蒸发浓缩、冷却结晶,抽滤得到K2Cr2O7粗产品。则相同温度时的溶解度:Na2Cr2O7
(3)K2Cr2O7溶液中存在的平衡又可分解为以下两步:
(ⅰ)


(ⅱ)



①下列有关K2Cr2O7溶液的说法正确的有
A.加入少量硫酸,溶液颜色由橙色向黄色转变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
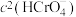 与
与 的比值保持不变
的比值保持不变②在0.10 mol⋅L-1 K2Cr2O7溶液中设
 、
、 、
、 的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为③已知在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围内,最大A对应的波长(
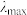 )取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与
)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K2Cr2O7稀溶液,测得其A随λ的变化曲线如右上图所示,波长λ1、λ2和λ3中,与 的
的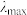 最接近的是
最接近的是 的值
的值
您最近半年使用:0次
名校
6 . 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。

已知:pH>6.5时Cr(Ⅵ)主要以 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。
(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为___________ 。
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:___________ 。
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是___________ 。
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为___________ 。
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数_______ (写出计算过程,结果保留1位小数)。
 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。
已知:pH>6.5时Cr(Ⅵ)主要以
 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数
您最近半年使用:0次
解题方法
7 .  是一种用途极为广泛的稀土化合物。以二氧化铈
是一种用途极为广泛的稀土化合物。以二氧化铈 废渣为原料制备
废渣为原料制备 ,实验过程如下
,实验过程如下
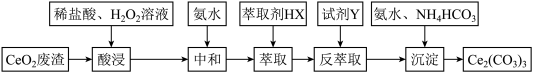
已知: 能被有机萃取剂
能被有机萃取剂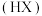 萃取,其萃取原理可表示为:
萃取,其萃取原理可表示为: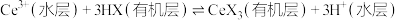 。下列说法正确的是
。下列说法正确的是
 是一种用途极为广泛的稀土化合物。以二氧化铈
是一种用途极为广泛的稀土化合物。以二氧化铈 废渣为原料制备
废渣为原料制备 ,实验过程如下
,实验过程如下
已知:
 能被有机萃取剂
能被有机萃取剂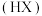 萃取,其萃取原理可表示为:
萃取,其萃取原理可表示为: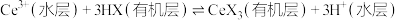 。下列说法正确的是
。下列说法正确的是A.“酸浸”过程中 做氧化剂 做氧化剂 |
| B.试剂Y一定是盐酸 |
C.加氨水“中和”去除过量盐酸,有利于平衡向萃取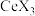 (有机层)的方向移动 (有机层)的方向移动 |
D.“沉淀”时反应的离子方程式为 |
您最近半年使用:0次
解题方法
8 . 下列解释事实的离子方程式不正确的是
A.在重铬酸钾溶液中滴入氢氧化钠溶液,溶液变为黄色: |
B.牙齿表面薄层釉质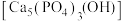 易被有机酸溶解从而导致龋齿,含氟牙膏能起到预防龋齿的作用的原理: 易被有机酸溶解从而导致龋齿,含氟牙膏能起到预防龋齿的作用的原理: |
C. 化学性质非常稳定,在工业上有着广泛用途,可用 化学性质非常稳定,在工业上有着广泛用途,可用 制备 制备 : : |
D.纯碱溶于水显碱性: |
您最近半年使用:0次
名校
解题方法
9 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子,原子核外有_______ 种不同能量的电子,写出其最外层电子的轨道表示式_______ ;碘元素在元素周期表中的位置是_______ ;液溴的保存通常采取的方法是_______ 。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
(3) 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是_______ 。
(4)已知: 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_______
(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_______
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是_______ (填字母)。
a.海盐提纯:

b.海水提镁:
c.海带提碘: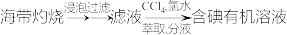

d.海水提溴:
(1)与氯元素同族的短周期元素的原子,原子核外有
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的氧化性 的氧化性 | B. 、 、 、 、 的熔点 的熔点 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 与
与 反应生成
反应生成 和一种黑色固体。在25℃、101kPa下,已知该反应消耗
和一种黑色固体。在25℃、101kPa下,已知该反应消耗 ,放热44.5kJ,该反应的热化学方程式是
,放热44.5kJ,该反应的热化学方程式是(4)已知:
 的熔点为1040℃,
的熔点为1040℃, 在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:(5)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(6)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a.海盐提纯:


b.海水提镁:

c.海带提碘:
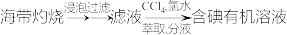

d.海水提溴:

您最近半年使用:0次
2022-11-11更新
|
167次组卷
|
2卷引用:湖北省黄冈市黄梅县育才高级中学2023-2024学年高二下学期3月月考化学试题
10 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)

b)

c)

d)

e)

(1)已知相关物质的燃烧热(25℃、101 kPa):
则△H1=___________ 。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a)


b)


c)


d)


e)


(1)已知相关物质的燃烧热(25℃、101 kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热(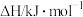 ) ) |  |  |  |
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.移去部分C(s),反应c、d、e的平衡均向右移动 |
| B.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近半年使用:0次



