1 . 关于反应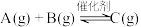
 ,下列说法正确的是
,下列说法正确的是
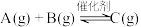
 ,下列说法正确的是
,下列说法正确的是| A.一定是自发反应 |
| B.温度升高,逆反应速率减慢 |
| C.反应物浓度增大,平衡向正反应方向进行 |
| D.催化剂不参与化学反应 |
您最近一年使用:0次
2 . 关于反应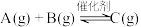
 ,下列说法正确的是
,下列说法正确的是
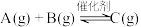
 ,下列说法正确的是
,下列说法正确的是| A.一定是自发反应 |
| B.温度升高,逆反应速率减慢 |
| C.反应物浓度增大,平衡不一定向正反应方向进行 |
| D.催化剂不参与化学反应 |
您最近一年使用:0次
名校
3 . 下列实验过程不能达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
| B | 证明压强对平衡移动产生影响 | 向充有NO2和N2O4混合气体的恒容透明密闭容器中充入氦气增大压强,观察现象 |
| C | 探究浓度对化学平衡的影响 | 试管中盛有0.1 mol·L−1 K2Cr2O7溶液,向其中滴加10滴6 mol·L−1 NaOH溶液,观察到溶液黄色加深 |
| D | 比较CdS(黄色)与CuS(黑色)的溶解度[已知Ksp(CdS)>Ksp(CuS)] | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-07更新
|
139次组卷
|
2卷引用:山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题
名校
4 . 如下实验对Fe3++3SCN- Fe(SCN)3平衡的影响,说法正确的是
Fe(SCN)3平衡的影响,说法正确的是
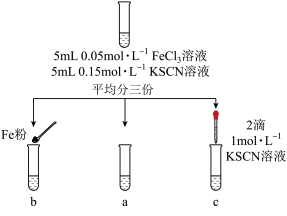
| A.若向试管a中加2mL水,由Q>K,判断平衡逆向移动 |
| B.向试管b中加少量铁粉,因c(Fe3+)增大,故平衡向正向移动 |
| C.向试管b中加少量铁粉,因c(Fe3+)减小,故平衡常数K增大 |
| D.向试管c中滴浓度较大的KSCN溶液,平衡常数K增大 |
您最近一年使用:0次
2023-11-08更新
|
176次组卷
|
3卷引用:山东省泰安市宁阳四中2023-2024学年高二上学期期末化学模拟试卷
5 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有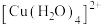 (蓝色)或
(蓝色)或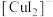 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
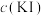 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
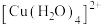 (蓝色)或
(蓝色)或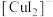 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
273次组卷
|
2卷引用:山东省青岛市第十九中学2023-2024学年高二上学期化学期末试卷
名校
6 . 铜氨法可用于测定气体中氧气浓度。该方法是以Cu作为还原剂,用一定量 和氨水的混合液作为吸收液吸收
和氨水的混合液作为吸收液吸收 ,其原理如图所示。
,其原理如图所示。 为蓝色,
为蓝色, 为无色。
为无色。
下列说法错误的是
 和氨水的混合液作为吸收液吸收
和氨水的混合液作为吸收液吸收 ,其原理如图所示。
,其原理如图所示。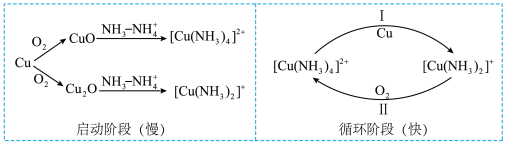
 为蓝色,
为蓝色, 为无色。
为无色。下列说法错误的是
A. 的作用是抑制氨水的电离,防止生成 的作用是抑制氨水的电离,防止生成 沉淀 沉淀 |
B.吸收过程中, 、 、 、 、 是中间产物 是中间产物 |
| C.启动阶段,氨气的加入加快铜氧化物溶于铵盐的速率 |
| D.随着吸收过程不断进行,当吸收液由蓝色变为无色时,表明吸收液已失效 |
您最近一年使用:0次
2023-07-15更新
|
131次组卷
|
2卷引用:山东省青岛市莱西市2022-2023学年高三上学期期末考试化学试题
名校
7 . 将 溶于水,加入浓盐酸,溶液由粉红色变为蓝色,存在平衡:
溶于水,加入浓盐酸,溶液由粉红色变为蓝色,存在平衡:

 。用该溶液做实验,溶液的颜色变化如图所示:
。用该溶液做实验,溶液的颜色变化如图所示:

已知: 为粉红色,
为粉红色,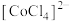 为蓝色,
为蓝色, 为无色。
为无色。
下列结论和解释正确的是
 溶于水,加入浓盐酸,溶液由粉红色变为蓝色,存在平衡:
溶于水,加入浓盐酸,溶液由粉红色变为蓝色,存在平衡:

 。用该溶液做实验,溶液的颜色变化如图所示:
。用该溶液做实验,溶液的颜色变化如图所示:
已知:
 为粉红色,
为粉红色,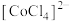 为蓝色,
为蓝色, 为无色。
为无色。下列结论和解释正确的是
A.由实验①可推知 |
B.由实验②可知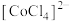 浓度减小, 浓度减小, 浓度增大 浓度增大 |
C.由实验③可推知加入 后溶液中 后溶液中 浓度减小 浓度减小 |
D.实验②是由于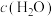 增大,导致平衡逆向移动 增大,导致平衡逆向移动 |
您最近一年使用:0次
2023-02-14更新
|
353次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
名校
8 . 某温度下,在恒容密闭容器中加入足量的 和1 mol
和1 mol  ,进行如下两个反应并达到平衡:①
,进行如下两个反应并达到平衡:①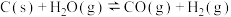 ;②
;②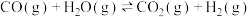 。下列叙述错误的是
。下列叙述错误的是
 和1 mol
和1 mol  ,进行如下两个反应并达到平衡:①
,进行如下两个反应并达到平衡:①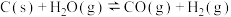 ;②
;②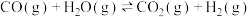 。下列叙述错误的是
。下列叙述错误的是| A.通入稀有气体Ne,①平衡正向移动 |
B.加入适量 ,①和②平衡均不移动 ,①和②平衡均不移动 |
| C.缩小容器体积,②平衡正向移动 |
D.平衡时 的体积分数一定小于 的体积分数一定小于 |
您最近一年使用:0次
2023-02-11更新
|
245次组卷
|
3卷引用:山东省淄博市2022-2023学年高二上学期期末考试化学试题
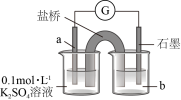
9 . 铁的化合物在工业脱硫工艺中有着重要应用。
Ⅰ.电解脱硫
煤中的含硫物质主要是FeS2,电解脱硫原理如图。
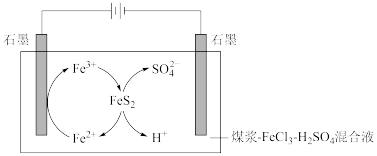
(1)阴极石墨棒上有无色气体产生,该气体是_______ (填化学式)。
(2)研究发现电解时若电压过高,阳极会有副反应发生,造成电解效率降低。某电压下电解100mL煤浆- FeCl3- H2SO4混合液,煤浆中除FeS2外无其它含硫物质, H2SO4浓度为0. 0lmol· L-1,当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c( )=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η(
)=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η( )=
)=_______ %[η(B)=  ]。
]。
(3)电解法脱硫的优点有_______ (写出一条即可)。
Ⅱ.生物脱硫
(4)Fe3+参与生物脱硫的过程分为吸收和再生两部分。
①吸收:Fe3+将工业废气中的H2S氧化为S
②再生:硫杆菌作用下O2氧化Fe2+再生Fe3+
硫杆菌生长的最佳pH范围是1. 4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
Ⅲ.络合脱硫
(5)碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,因此需将其制成可溶于水的配合物Fe(III)Ln(L表示配体,n表示配位数)。脱硫过程包含如下两步反应:
①碱性条件下,Fe(Ⅲ)Ln氧化H2S生成S8,离子方程式为_______ 。
②O2氧化再生Fe(Ⅲ)Ln,离子方程式为4Fe(Ⅱ)Ln+O2+2H2O=4Fe(Ⅲ)Ln +4OH-。脱硫过程总反应的化学方程式为_______ 。
(6)Na2H2Y (结构简式为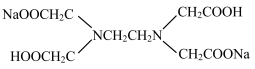 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是_______ 。
Ⅰ.电解脱硫
煤中的含硫物质主要是FeS2,电解脱硫原理如图。

(1)阴极石墨棒上有无色气体产生,该气体是
(2)研究发现电解时若电压过高,阳极会有副反应发生,造成电解效率降低。某电压下电解100mL煤浆- FeCl3- H2SO4混合液,煤浆中除FeS2外无其它含硫物质, H2SO4浓度为0. 0lmol· L-1,当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(
 )=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η(
)=0.02mol·L-1,若忽略电解前后溶液体积变化,电解效率η( )=
)= ]。
]。(3)电解法脱硫的优点有
Ⅱ.生物脱硫
(4)Fe3+参与生物脱硫的过程分为吸收和再生两部分。
①吸收:Fe3+将工业废气中的H2S氧化为S
②再生:硫杆菌作用下O2氧化Fe2+再生Fe3+
硫杆菌生长的最佳pH范围是1. 4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
Ⅲ.络合脱硫
(5)碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,因此需将其制成可溶于水的配合物Fe(III)Ln(L表示配体,n表示配位数)。脱硫过程包含如下两步反应:
①碱性条件下,Fe(Ⅲ)Ln氧化H2S生成S8,离子方程式为
②O2氧化再生Fe(Ⅲ)Ln,离子方程式为4Fe(Ⅱ)Ln+O2+2H2O=4Fe(Ⅲ)Ln +4OH-。脱硫过程总反应的化学方程式为
(6)Na2H2Y (结构简式为
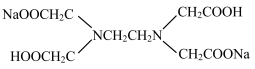 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
您最近一年使用:0次
名校
10 . 向甲、乙两个体积均为2L的恒容密闭容器中分别充入20mol的M,发生反应:
 ,维持容器的温度分别为
,维持容器的温度分别为 ℃和
℃和 ℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
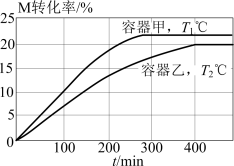

 ,维持容器的温度分别为
,维持容器的温度分别为 ℃和
℃和 ℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
℃不变,反应过程中M的转化率随时间的变化如图所示。下列说法错误的是
A.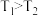 |
| B.维持温度不变,向平衡后的甲容器中充入一定量的M,平衡不移动 |
C. ℃时,反应的平衡常数: ℃时,反应的平衡常数: |
D.  ℃时,向平衡后的乙容器再充入16mol M和2mol N,反应正向进行 ℃时,向平衡后的乙容器再充入16mol M和2mol N,反应正向进行 |
您最近一年使用:0次
2023-02-08更新
|
198次组卷
|
3卷引用:山东省泰安市2022-2023学年高三上学期1月期末考试化学试题



