1 . 测定平衡常数对定量认识化学反应具有重要意义。已知: 能与
能与 反应生成
反应生成 ,在水溶液中建立平衡:
,在水溶液中建立平衡: 。通过测定平衡体系中的
。通过测定平衡体系中的 、
、 和
和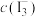 ,就可求得该反应的平衡常数。回答下列问题:
,就可求得该反应的平衡常数。回答下列问题:
I.同学甲为测定上述平衡体系中 ,采取如下方法:取
,采取如下方法:取 上述平衡体系的混合溶液,用
上述平衡体系的混合溶液,用 的
的 溶液进行滴定(反应为
溶液进行滴定(反应为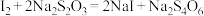 ),消耗
),消耗 溶液
溶液 。根据
。根据 、
、 和c可求得
和c可求得 。
。
(1)上述滴定时,可采用___________ 作指示剂,滴定终点的现象为___________ 。
(2)同学乙认为该甲设计方案不合理,原因是甲测得的 实际为平衡体系中
实际为平衡体系中___________ 的物质的量浓度之和(填化学式)。
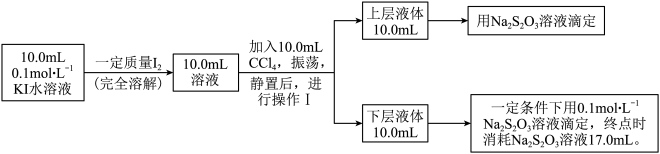
Ⅱ.乙对上述方案进行改进,室温下测定水溶液中该反应平衡常数的过程如下(溶液体积变化忽略不计): 和
和 不溶于
不溶于 ;室温下,碘单质在四氯化碳和水混合液体中的浓度比值即
;室温下,碘单质在四氯化碳和水混合液体中的浓度比值即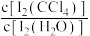 是常数(用Kd表示,称为分配系数),室温条件下Kd=85。
是常数(用Kd表示,称为分配系数),室温条件下Kd=85。
(3)操作I的名称为___________ 。
(4)若分别用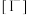 、
、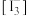 、
、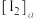 表示
表示上层 液体中 、
、 和
和 的物质的量浓度,用
的物质的量浓度,用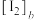 表示
表示下层 液体中 的物质的量浓度,则反应
的物质的量浓度,则反应 的平衡常数K的表达式为
的平衡常数K的表达式为___________ ,上层液体中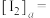
___________  。
。
(5)实验测得上层溶液 的c( )=0.0045 mol·L-1,结合上述有关数据,计算出该反应的平衡常数K=
)=0.0045 mol·L-1,结合上述有关数据,计算出该反应的平衡常数K=___________ (保留三位有效数字)。
 能与
能与 反应生成
反应生成 ,在水溶液中建立平衡:
,在水溶液中建立平衡: 。通过测定平衡体系中的
。通过测定平衡体系中的 、
、 和
和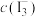 ,就可求得该反应的平衡常数。回答下列问题:
,就可求得该反应的平衡常数。回答下列问题:I.同学甲为测定上述平衡体系中
 ,采取如下方法:取
,采取如下方法:取 上述平衡体系的混合溶液,用
上述平衡体系的混合溶液,用 的
的 溶液进行滴定(反应为
溶液进行滴定(反应为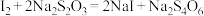 ),消耗
),消耗 溶液
溶液 。根据
。根据 、
、 和c可求得
和c可求得 。
。(1)上述滴定时,可采用
(2)同学乙认为该甲设计方案不合理,原因是甲测得的
 实际为平衡体系中
实际为平衡体系中Ⅱ.乙对上述方案进行改进,室温下测定水溶液中该反应平衡常数的过程如下(溶液体积变化忽略不计):
 和
和 不溶于
不溶于 ;室温下,碘单质在四氯化碳和水混合液体中的浓度比值即
;室温下,碘单质在四氯化碳和水混合液体中的浓度比值即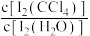 是常数(用Kd表示,称为分配系数),室温条件下Kd=85。
是常数(用Kd表示,称为分配系数),室温条件下Kd=85。(3)操作I的名称为
(4)若分别用
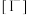 、
、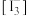 、
、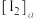 表示
表示 、
、 和
和 的物质的量浓度,用
的物质的量浓度,用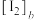 表示
表示 的物质的量浓度,则反应
的物质的量浓度,则反应 的平衡常数K的表达式为
的平衡常数K的表达式为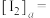
 。
。(5)实验测得
 )=0.0045 mol·L-1,结合上述有关数据,计算出该反应的平衡常数K=
)=0.0045 mol·L-1,结合上述有关数据,计算出该反应的平衡常数K=
您最近一年使用:0次
解题方法
2 . 氙的氟化物是优良的氟化剂,稀有气体Xe和 混合在催化剂作用下同时存在如下反应:
混合在催化剂作用下同时存在如下反应:
I.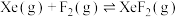
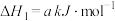
II.
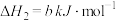
III.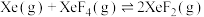
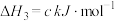
回答下列问题:
(1)向VL密闭容器中加入nmol的Xe和2mol的 ,发生上述反应。相同时间内,测得Xe的转化率和
,发生上述反应。相同时间内,测得Xe的转化率和 的选择性与温度的变化关系如图所示(
的选择性与温度的变化关系如图所示( 选择性是指生成
选择性是指生成 的物质的量与消耗Xe的物质的量比值)。高于1000℃,
的物质的量与消耗Xe的物质的量比值)。高于1000℃, 选择性随着温度升高而
选择性随着温度升高而___________ (填“升高”“降低”或“不变”),原因可能是___________ 。 表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比。保持其它条件不变,1000℃时,测得
表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比。保持其它条件不变,1000℃时,测得 随时间t的变化如图所示,且平衡时
随时间t的变化如图所示,且平衡时 的选择性小于
的选择性小于 的选择性。图中表示
的选择性。图中表示 变化的曲线是
变化的曲线是___________ (填标号);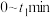
 的平均反应速率
的平均反应速率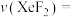
___________  ;Xe的转化率=
;Xe的转化率=___________ ;反应过程能量变化为___________ kJ(用含n,a和b的代数式表示),反应1的平衡常数K=___________ (用含n,V的代数式表示)。
 混合在催化剂作用下同时存在如下反应:
混合在催化剂作用下同时存在如下反应:I.
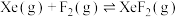
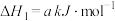
II.

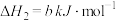
III.
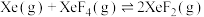
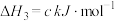
回答下列问题:
(1)向VL密闭容器中加入nmol的Xe和2mol的
 ,发生上述反应。相同时间内,测得Xe的转化率和
,发生上述反应。相同时间内,测得Xe的转化率和 的选择性与温度的变化关系如图所示(
的选择性与温度的变化关系如图所示( 选择性是指生成
选择性是指生成 的物质的量与消耗Xe的物质的量比值)。高于1000℃,
的物质的量与消耗Xe的物质的量比值)。高于1000℃, 选择性随着温度升高而
选择性随着温度升高而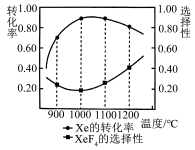
 表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比。保持其它条件不变,1000℃时,测得
表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比。保持其它条件不变,1000℃时,测得 随时间t的变化如图所示,且平衡时
随时间t的变化如图所示,且平衡时 的选择性小于
的选择性小于 的选择性。图中表示
的选择性。图中表示 变化的曲线是
变化的曲线是
 的平均反应速率
的平均反应速率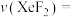
 ;Xe的转化率=
;Xe的转化率=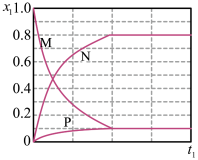
您最近一年使用:0次
3 . 草酸( )是二元弱酸。某小组往30mL
)是二元弱酸。某小组往30mL
 溶液中分别滴加等物质的量浓度的NaOH溶液、
溶液中分别滴加等物质的量浓度的NaOH溶液、 溶液。已知:常温下,
溶液。已知:常温下, 的电离平衡常数
的电离平衡常数 ,
,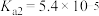 ;
;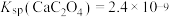 。溶液混合后体积变化忽略不计。回答下列问题:
。溶液混合后体积变化忽略不计。回答下列问题:
(1) 水解的离子方程式为
水解的离子方程式为___________ 。常温下,
 溶液显
溶液显___________ (填“酸性”“碱性”或“中性”)。
(2)滴加NaOH溶液的实验中,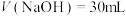 时,
时,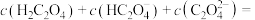
___________  ;滴至溶液pH=5时,溶液中
;滴至溶液pH=5时,溶液中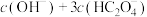
___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)滴加 溶液时,观察到有白色沉淀生成。
溶液时,观察到有白色沉淀生成。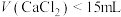 时,反应的离子方程式为
时,反应的离子方程式为___________ ;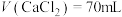 时,溶液中
时,溶液中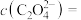
___________  。
。
 )是二元弱酸。某小组往30mL
)是二元弱酸。某小组往30mL
 溶液中分别滴加等物质的量浓度的NaOH溶液、
溶液中分别滴加等物质的量浓度的NaOH溶液、 溶液。已知:常温下,
溶液。已知:常温下, 的电离平衡常数
的电离平衡常数 ,
,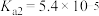 ;
;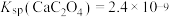 。溶液混合后体积变化忽略不计。回答下列问题:
。溶液混合后体积变化忽略不计。回答下列问题:(1)
 水解的离子方程式为
水解的离子方程式为
 溶液显
溶液显(2)滴加NaOH溶液的实验中,
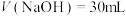 时,
时,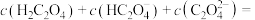
 ;滴至溶液pH=5时,溶液中
;滴至溶液pH=5时,溶液中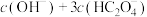
 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)滴加
 溶液时,观察到有白色沉淀生成。
溶液时,观察到有白色沉淀生成。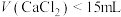 时,反应的离子方程式为
时,反应的离子方程式为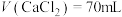 时,溶液中
时,溶液中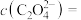
 。
。
您最近一年使用:0次
4 .  、
、 分别溶于氨水可形成
分别溶于氨水可形成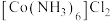 、
、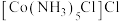 、
、 、
、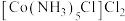 等多种配合物。回答下列问题:
等多种配合物。回答下列问题:
(1)Co在元素周期表中的位置为___________ ,第四电离能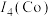
___________ 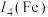 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)1mol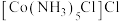 含
含 键的数为
键的数为___________ 。将含有未成对电子的物质置于外磁场中,会使磁场强度增大,这样的物质被称为顺磁性物质。
___________ (填“是”或“不是”)顺磁性物质。
(3)氨分子与 形成
形成 后,键角
后,键角___________ (填“变大”“变小”或“不变”)。溶液中 、
、 和浓氨水混合后,与
和浓氨水混合后,与 溶液反应生成
溶液反应生成 ,化学方程式为
,化学方程式为___________ 。
(4)现有等物质的量的 和
和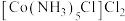 ,分别与足量的
,分别与足量的 反应,理论上生成AgCl的物质的量之比为
反应,理论上生成AgCl的物质的量之比为___________ 。
 、
、 分别溶于氨水可形成
分别溶于氨水可形成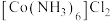 、
、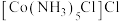 、
、 、
、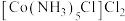 等多种配合物。回答下列问题:
等多种配合物。回答下列问题:(1)Co在元素周期表中的位置为
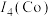
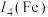 (填“>”“<”或“=”)
(填“>”“<”或“=”)(2)1mol
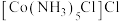 含
含 键的数为
键的数为
(3)氨分子与
 形成
形成 后,键角
后,键角 、
、 和浓氨水混合后,与
和浓氨水混合后,与 溶液反应生成
溶液反应生成 ,化学方程式为
,化学方程式为(4)现有等物质的量的
 和
和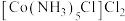 ,分别与足量的
,分别与足量的 反应,理论上生成AgCl的物质的量之比为
反应,理论上生成AgCl的物质的量之比为
您最近一年使用:0次
解题方法
5 . 含碳、氮的化合物广泛存在于自然界中。回答下列问题:
(1)Sb和N同族,原子序数为51,基态Sb原子的价电子排布式为___________ 。
(2)在有机反应中有许多活性中间体,如异丁烯与水加成中生成的 ,其中C的轨道杂化方式有
,其中C的轨道杂化方式有___________ , 中C-C间的夹角度数为
中C-C间的夹角度数为___________ 。
(3)成键原子中的孤电子对对键能有影响,现有化合物:① ②
② ③
③ ,其中标出的单键的键能(单位:
,其中标出的单键的键能(单位: )由大到小的顺序为
)由大到小的顺序为___________ ,原因是___________ 。
(4)醋酸(熔点16.6℃)和硝酸(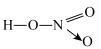 ,熔点-42℃)的相对分子质量接近,但两种物质的熔沸点相差较大,原因是
,熔点-42℃)的相对分子质量接近,但两种物质的熔沸点相差较大,原因是___________ 。
(5) 具有较强的配位能力,能与
具有较强的配位能力,能与 形成一种长链离子,其片段为
形成一种长链离子,其片段为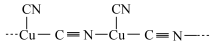 ,该离子的化学式为
,该离子的化学式为___________ 。
(1)Sb和N同族,原子序数为51,基态Sb原子的价电子排布式为
(2)在有机反应中有许多活性中间体,如异丁烯与水加成中生成的
 ,其中C的轨道杂化方式有
,其中C的轨道杂化方式有 中C-C间的夹角度数为
中C-C间的夹角度数为(3)成键原子中的孤电子对对键能有影响,现有化合物:①
 ②
② ③
③ ,其中标出的单键的键能(单位:
,其中标出的单键的键能(单位: )由大到小的顺序为
)由大到小的顺序为(4)醋酸(熔点16.6℃)和硝酸(
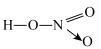 ,熔点-42℃)的相对分子质量接近,但两种物质的熔沸点相差较大,原因是
,熔点-42℃)的相对分子质量接近,但两种物质的熔沸点相差较大,原因是(5)
 具有较强的配位能力,能与
具有较强的配位能力,能与 形成一种长链离子,其片段为
形成一种长链离子,其片段为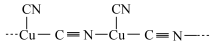 ,该离子的化学式为
,该离子的化学式为
您最近一年使用:0次
解题方法
6 . 燃煤废气中的 转化为二甲醚的反应原理为:
转化为二甲醚的反应原理为: ,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在容器甲中充入1mol
,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在容器甲中充入1mol 和3mol
和3mol ,在容器乙中充入2mol
,在容器乙中充入2mol 和6mol
和6mol ,发生上述反应并达到平衡。该反应中
,发生上述反应并达到平衡。该反应中 的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内
的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内 的转化率随温度变化如图2所示。下列说法正确的是
的转化率随温度变化如图2所示。下列说法正确的是
 转化为二甲醚的反应原理为:
转化为二甲醚的反应原理为: ,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在容器甲中充入1mol
,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在容器甲中充入1mol 和3mol
和3mol ,在容器乙中充入2mol
,在容器乙中充入2mol 和6mol
和6mol ,发生上述反应并达到平衡。该反应中
,发生上述反应并达到平衡。该反应中 的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内
的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内 的转化率随温度变化如图2所示。下列说法正确的是
的转化率随温度变化如图2所示。下列说法正确的是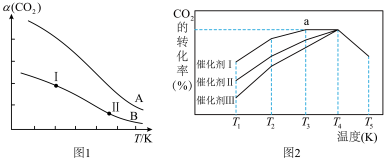
A.图1中,表示乙容器 的平衡转化率随温度变化的是曲线B 的平衡转化率随温度变化的是曲线B |
B.图1中,逆反应速率 :状态I<状态Ⅱ :状态I<状态Ⅱ |
| C.图2中,a点达到化学平衡状态 |
D.图2中, 对应的平衡常数小于 对应的平衡常数小于 对应的平衡常数 对应的平衡常数 |
您最近一年使用:0次
7 . 常温下,向20mL浓度均为 的HY溶液和HZ溶液中,逐滴加入
的HY溶液和HZ溶液中,逐滴加入 的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出
的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出 浓度的负对数
浓度的负对数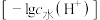 与所加NaOH溶液体积的关系。下列说法错误的是
与所加NaOH溶液体积的关系。下列说法错误的是
 的HY溶液和HZ溶液中,逐滴加入
的HY溶液和HZ溶液中,逐滴加入 的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出
的NaOH溶液,曲线I、曲线Ⅱ分别代表反应后HY溶液和HZ溶液中水电离出 浓度的负对数
浓度的负对数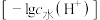 与所加NaOH溶液体积的关系。下列说法错误的是
与所加NaOH溶液体积的关系。下列说法错误的是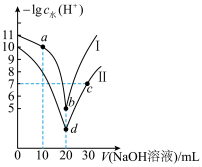
| A.c点溶液显中性 |
B.在a点,存在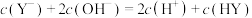 |
C.b、d两点存在: |
D. 的HY和NaZ溶液等体积混合,溶液呈酸性 的HY和NaZ溶液等体积混合,溶液呈酸性 |
您最近一年使用:0次
解题方法
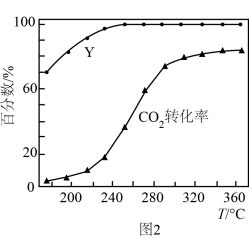
8 .  催化
催化 加
加 的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中
的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中 的物质的量百分数(Y)及
的物质的量百分数(Y)及 的转化率随温度(T)的变化如图2所示。下列说法正确的是
的转化率随温度(T)的变化如图2所示。下列说法正确的是
 催化
催化 加
加 的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中
的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中 的物质的量百分数(Y)及
的物质的量百分数(Y)及 的转化率随温度(T)的变化如图2所示。下列说法正确的是
的转化率随温度(T)的变化如图2所示。下列说法正确的是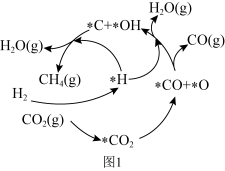
A.220℃时主反应的化学方程式为: |
B.240℃之前,随温度升高,催化剂对反应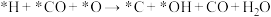 (未配平)的选择性增大 (未配平)的选择性增大 |
| C.温度高于260℃后,升高温度,甲烷产率增大 |
D.综合图像分析,含碳副产物的产率均低于 |
您最近一年使用:0次
解题方法
9 . 短周期主族元素W、X、Y、Z、M的原子序数依次增大,W是元素周期表中s区电负性最大的元素;Y基态原子s能级电子数等于p能级电子数,X的最高正价与最低负价代数和为0;Y、M同主族,Z的逐级电离能(单位kJ/mol)依次为578、1817、2745、11578。下列说法不正确的是
| A.MY2与O3互为等电子体 | B.Z、Y形成的化合物中阴阳离子个数比为1:2 |
| C.简单离子半径大小:M>Y>Z | D.电负性:Y>M>X |
您最近一年使用:0次
10 . “肼合成酶”以其中的 配合物为催化中心,可将
配合物为催化中心,可将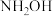 与
与 转化为肼(
转化为肼( ),其反应历程如下:
),其反应历程如下:
 配合物为催化中心,可将
配合物为催化中心,可将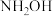 与
与 转化为肼(
转化为肼( ),其反应历程如下:
),其反应历程如下: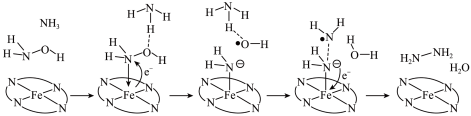
A. 配合物可降低反应的活化能 配合物可降低反应的活化能 | B.反应过程中不涉及非极性键的形成 |
| C.反应过程中没有元素化合价的变化 | D.将 替换为 替换为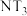 ,反应可得 ,反应可得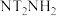 |
您最近一年使用:0次



