名校
1 . 碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长。因此,诸多科学家都在大力研合理利用 和CO以减少碳的排放。
和CO以减少碳的排放。
(1) 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。
a.
b.
c.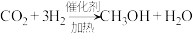
已知: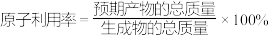
以上反应中,最环保节能的是_______ ,原子利用率最高的是_______ 。(填编号)
(2)我国科学家设计出一条仅11步的工业合成路线,实现了 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
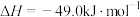 。回答下列问题:
。回答下列问题:
①能说明该反应已达平衡状态的是_______ (填字母)。
A.单位时间内生成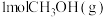 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)_______ Ea(逆)(填“>”、“=”或“<”)
(3)利用CO高温时与磷石膏(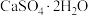 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为_______ (填化学式)。
②在1150℃时,向盛有足量 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: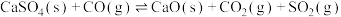 。该反应达到平衡时,
。该反应达到平衡时,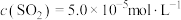 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时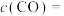
_______ mol/L,该反应的压强平衡常数
_______ MPa(忽略副反应;气体分压=总压×气体物质的量分数)。
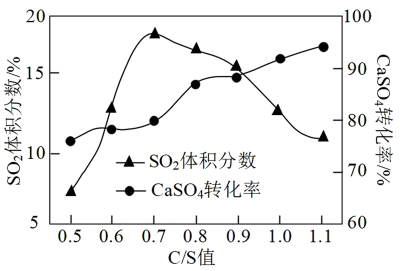
(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是_______ 。
 和CO以减少碳的排放。
和CO以减少碳的排放。(1)
 可通过以下4种方式转化成有机物,从而有效实现碳循环。
可通过以下4种方式转化成有机物,从而有效实现碳循环。a.

b.

c.
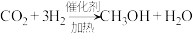
已知:
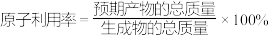
以上反应中,最环保节能的是
(2)我国科学家设计出一条仅11步的工业合成路线,实现了
 到淀粉的合成。其第一步是把
到淀粉的合成。其第一步是把 还原为甲醇(
还原为甲醇( ),该方法的化学方程式是:
),该方法的化学方程式是:
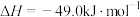 。回答下列问题:
。回答下列问题:①能说明该反应已达平衡状态的是
A.单位时间内生成
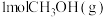 的同时消耗了
的同时消耗了
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,混合气体的密度不再变化
②该反应正逆反应的活化能大小为:Ea(正)
(3)利用CO高温时与磷石膏(
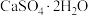 )反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。
)反应,可减少CO的排放,又可以实现硫酸盐资源的再利用。已知该反应的产物与温度有关。①在700℃时,主要的还原产物是一种硫的最低价盐,该物质为
②在1150℃时,向盛有足量
 的真空恒容密闭容器中充入一定量CO,反应体系起始压强为
的真空恒容密闭容器中充入一定量CO,反应体系起始压强为 ,主要发生反应:
,主要发生反应: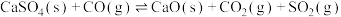 。该反应达到平衡时,
。该反应达到平衡时,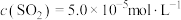 ,CO的转化率为50%,则初始时
,CO的转化率为50%,则初始时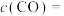

(4)工业上也可用炭粉还原磷石膏,该反应的产物与C/S值(炭粉与
 的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、
的物质的量之比)有关。向密闭容器中加入几组不同C/S值的炭粉与磷石膏的混合物,1100℃煅烧至无气体产生,结果如图所示。当C/S值为0.5时,反应产物主要为CaO、 和
和 ;当C/S值大于0.7时,反应所得气体中
;当C/S值大于0.7时,反应所得气体中 的体积分数下降,可能的原因是
的体积分数下降,可能的原因是
您最近一年使用:0次
2022-09-21更新
|
142次组卷
|
2卷引用:重庆市璧山来凤中学校2022-2023学年高二上学期9月月考化学试题
名校
解题方法
2 .  常用作有机合成催化剂,现有如下两种方法制备
常用作有机合成催化剂,现有如下两种方法制备 。已知:
。已知: 晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的
晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的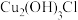 ,且易见光分解。
,且易见光分解。
方法一:利用热分解 (绿色)制备
(绿色)制备 ,并进行相关探究。
,并进行相关探究。
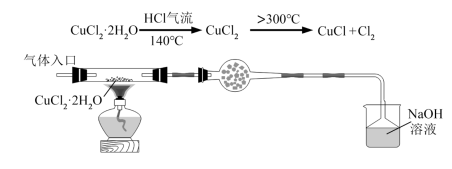
(1)将下列实验操作按先后顺序排列为:a→→→→→→d______
a.检查装置的气密性后加入药品 b.点燃酒精灯加热至 ,反应一段时间
,反应一段时间
c.调整酒精灯温度 ,反应一段时间 d.停止通入
,反应一段时间 d.停止通入
e.停止通入 ,然后通入干燥
,然后通入干燥 f.在“气体入口”处通入干燥
f.在“气体入口”处通入干燥
g.熄灭酒精灯
(2)当观察到___________ 时,反应达到终点,停止加热。
方法二:以 (含少量
(含少量 )粗品为原料制取
)粗品为原料制取 ,设计的合成路线如下:
,设计的合成路线如下:
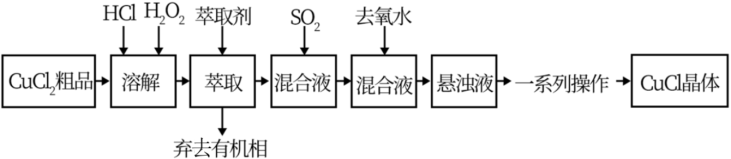
查阅资料可知:①在较高的盐酸浓度下, 能溶解于甲基异丁基甲酮:
能溶解于甲基异丁基甲酮:
② 在溶液中存在:
在溶液中存在: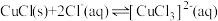 。
。
(3)写出 通入混合液中发生的反应的离子方程式
通入混合液中发生的反应的离子方程式___________ 。
(4)下列叙述正确的是___________(填字母)。

(5)向混合液中加入去氧水的目的是___________ 。
(6)现称取 产品,用硫酸酸化的硫酸铁完全溶解,并稀释成
产品,用硫酸酸化的硫酸铁完全溶解,并稀释成 。每次用移液管移取
。每次用移液管移取 溶液于锥形瓶中,再用
溶液于锥形瓶中,再用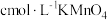 溶液滴定,平均消耗
溶液滴定,平均消耗 。
。
①按该实验方案计算产品的纯度为___________ %。
②有同学认为该实验方案明显不合理,会导致计算的 纯度
纯度___________ (填“偏高”或“偏低”)
 常用作有机合成催化剂,现有如下两种方法制备
常用作有机合成催化剂,现有如下两种方法制备 。已知:
。已知: 晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的
晶体呈白色,微溶于水,不溶于稀盐酸,露置于潮湿空气中易转化为绿色的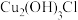 ,且易见光分解。
,且易见光分解。方法一:利用热分解
 (绿色)制备
(绿色)制备 ,并进行相关探究。
,并进行相关探究。
(1)将下列实验操作按先后顺序排列为:a→→→→→→d
a.检查装置的气密性后加入药品 b.点燃酒精灯加热至
 ,反应一段时间
,反应一段时间c.调整酒精灯温度
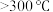 ,反应一段时间 d.停止通入
,反应一段时间 d.停止通入
e.停止通入
 ,然后通入干燥
,然后通入干燥 f.在“气体入口”处通入干燥
f.在“气体入口”处通入干燥
g.熄灭酒精灯
(2)当观察到
方法二:以
 (含少量
(含少量 )粗品为原料制取
)粗品为原料制取 ,设计的合成路线如下:
,设计的合成路线如下:
查阅资料可知:①在较高的盐酸浓度下,
 能溶解于甲基异丁基甲酮:
能溶解于甲基异丁基甲酮:②
 在溶液中存在:
在溶液中存在: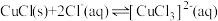 。
。(3)写出
 通入混合液中发生的反应的离子方程式
通入混合液中发生的反应的离子方程式(4)下列叙述正确的是___________(填字母)。

A. 原料中含有的 原料中含有的 经氧化、萃取几乎都在有机相中被除去 经氧化、萃取几乎都在有机相中被除去 |
| B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇 |
| C.上述合成路线中,一系列操作包括:抽滤、洗涤、干燥,且干燥时应注意密封、避光 |
D.该流程中温度越高越有利于将 转化为 转化为 |
(6)现称取
 产品,用硫酸酸化的硫酸铁完全溶解,并稀释成
产品,用硫酸酸化的硫酸铁完全溶解,并稀释成 。每次用移液管移取
。每次用移液管移取 溶液于锥形瓶中,再用
溶液于锥形瓶中,再用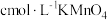 溶液滴定,平均消耗
溶液滴定,平均消耗 。
。①按该实验方案计算产品的纯度为
②有同学认为该实验方案明显不合理,会导致计算的
 纯度
纯度
您最近一年使用:0次
名校
解题方法
3 . 聚醋酸乙烯酯难溶于水,可用作白乳胶、塑料薄膜和涂料等,用它可得到聚乙烯醇,聚乙烯醇水溶液可用作医用滴眼液。合成路线如下:
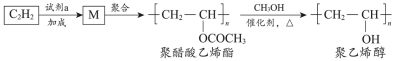
已知: (R’、
(R’、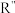 不同的羟基)
不同的羟基)
下列说法不正确 的是

已知:
 (R’、
(R’、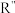 不同的羟基)
不同的羟基)下列说法
| A.试剂a是乙酸 |
| B.通过增加甲醇用量可提高聚乙烯醇的产率 |
| C.由M转化为聚醋酸乙烯酯的过程中发生了缩聚反应 |
| D.由聚醋酸乙烯酯转化为聚乙烯醇过程中还会生成乙酸甲酯 |
您最近一年使用:0次
名校
4 . Ⅰ.已知: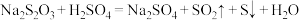 ,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
(1)Na2S2O3中S的化合价为 _______ 价
(2)该实验①、②可探究温度对反应速率的影响,因此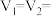
_______ ,V3=_______
(3)若实验①、③探究硫酸浓度对反应速率的影响,V4=_______ ,V5=_______ 。
Ⅱ.在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
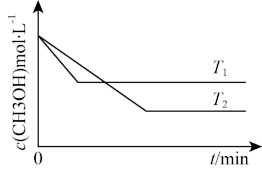
(4)△H_______ (填“>”“<”或“=”)0
(5)在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率_______ (填“增大”“减小”或“不变”)。
(6)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为_______ mol/(L·min)。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
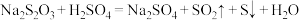 ,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:| 实验序号 | 反应温度/ |  溶液 溶液 | 稀 |  | ||
 |  |  | 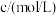 |  | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 |  | 0.10 |  | 0.50 |  |
| ③ | 20 |  | 0.10 | 4.0 | 0.50 | 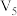 |
(2)该实验①、②可探究温度对反应速率的影响,因此
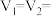
(3)若实验①、③探究硫酸浓度对反应速率的影响,V4=
Ⅱ.在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:

(4)△H
(5)在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(6)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
您最近一年使用:0次
解题方法
5 . 工业上硫酸锰( )常作合成脂肪酸的催化剂。以软锰矿(主要成分为
)常作合成脂肪酸的催化剂。以软锰矿(主要成分为 ,还含有
,还含有 、
、 、CaO、
、CaO、 等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:
等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:

(1)“酸浸”前需要将软锰矿粉碎,理由是______ ,废铁屑先与稀硫酸反应生成 ,生成的
,生成的 再与
再与 反应,该过程中每生成
反应,该过程中每生成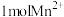 ,至少要消耗
,至少要消耗_______ 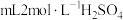 溶液。
溶液。
(2)“滤渣1”的主要成分是______ (填化学式,下同),“滤渣3”的主要成分是_______ 。
(3)“滤渣2”的主要成分为 和
和 ,从化学平衡的角度分析:加
,从化学平衡的角度分析:加 生成“滤渣2”的原因是
生成“滤渣2”的原因是___________ (用离子方程式结合文字表述)。
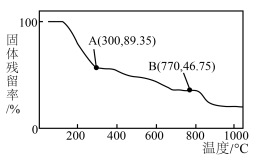
(4)在空气中加热 ,固体残留率随温度的变化如图所示。A点对应固体的成分为
,固体残留率随温度的变化如图所示。A点对应固体的成分为___________ (填化学式,下同),B点对应固体的成分为___________ 。
(5)工业上,常用惰性电极电解硫酸酸化的 溶液制取
溶液制取 。若外电路转移
。若外电路转移 (
( 为阿佛伽德罗常数的值)个电子,则理论上阳极获得
为阿佛伽德罗常数的值)个电子,则理论上阳极获得___________ 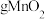 。
。
 )常作合成脂肪酸的催化剂。以软锰矿(主要成分为
)常作合成脂肪酸的催化剂。以软锰矿(主要成分为 ,还含有
,还含有 、
、 、CaO、
、CaO、 等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:
等)与废铁屑为原料制取硫酸锰的工艺流程如图所示,回答下列问题:
(1)“酸浸”前需要将软锰矿粉碎,理由是
 ,生成的
,生成的 再与
再与 反应,该过程中每生成
反应,该过程中每生成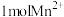 ,至少要消耗
,至少要消耗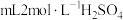 溶液。
溶液。(2)“滤渣1”的主要成分是
(3)“滤渣2”的主要成分为
 和
和 ,从化学平衡的角度分析:加
,从化学平衡的角度分析:加 生成“滤渣2”的原因是
生成“滤渣2”的原因是(4)在空气中加热
 ,固体残留率随温度的变化如图所示。A点对应固体的成分为
,固体残留率随温度的变化如图所示。A点对应固体的成分为
(5)工业上,常用惰性电极电解硫酸酸化的
 溶液制取
溶液制取 。若外电路转移
。若外电路转移 (
( 为阿佛伽德罗常数的值)个电子,则理论上阳极获得
为阿佛伽德罗常数的值)个电子,则理论上阳极获得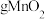 。
。
您最近一年使用:0次
6 . 二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要含有CeFCO3)为原料制备二氧化铈的一种工艺流程如图:
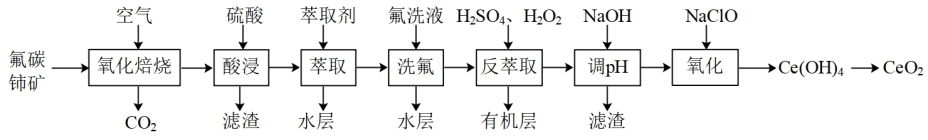
已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率、提高原料利用率的措施有_______ 。(写一种,合理即可)
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,二者物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。
(3)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP→CeTBP4++F-,氟洗液中添加Al3+的作用是_______ 。
(4)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为_______ 。
(5)“反萃取”后的水层溶液中c(Ce3+)=1mol·L-1,c(Al3+)=0.01mol·L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则需加入NaOH调节溶液pH的范围为_______ ,过滤后,再向滤液加入NaOH使Ce3+沉淀完全(已知:室温下,当溶液中的离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。K[Al(OH)3]=1.0×10-32,K[Ce(OH)3]=1.0×10-21)。
(6)“氧化”时发生反应的化学方程式为_______
(7)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得CeO24.48吨,则CeO2的产率为_______ (保留三位有效数字)。

已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。回答下列问题:(1)“氧化焙烧”时,为了加快反应速率、提高原料利用率的措施有
(2)“氧化焙烧”后的固体产物中含有CeO2和CeF4,二者物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP→CeTBP4++F-,氟洗液中添加Al3+的作用是
(4)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为
(5)“反萃取”后的水层溶液中c(Ce3+)=1mol·L-1,c(Al3+)=0.01mol·L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则需加入NaOH调节溶液pH的范围为
(6)“氧化”时发生反应的化学方程式为
(7)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得CeO24.48吨,则CeO2的产率为
您最近一年使用:0次
解题方法
7 . 研究CO和 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。
(1)用CO和 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
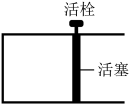
①能够说明反应已经处于平衡状态的是:_________ 。
A.容器内CO的物质的量浓度不变
B.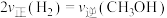
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内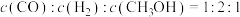
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时 的体积百分含量将
的体积百分含量将_________ (填“增大”、“减少”或“不变”)
(2)二氧化碳是潜在的碳资源,可以与 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。
①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为: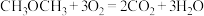 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为_________ 。

②以二氧化钛表面覆盖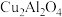 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:_________ 。

 的应用对构建生态文明型社会具有重要意义。
的应用对构建生态文明型社会具有重要意义。(1)用CO和
 为原料可制取甲醇:
为原料可制取甲醇:
 。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和
。恒温时,向如图所示的密闭容器中(活栓已经固定住活塞)充入一定量的CO和 。
。
①能够说明反应已经处于平衡状态的是:
A.容器内CO的物质的量浓度不变
B.
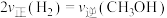
C.容器内气体压强不变
D.混合气体的密度不变
E.容器内
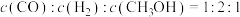
②若其他条件均保持不变,起始时拔去活栓,让活塞自由移动,则平衡时
 的体积百分含量将
的体积百分含量将(2)二氧化碳是潜在的碳资源,可以与
 合成二甲醚(化学式为
合成二甲醚(化学式为 ),也可以与
),也可以与 直接转化为乙酸。
直接转化为乙酸。①一种“二甲醚燃料电池”的结构如图所示,以熔融的碳酸钾为电解质,总反应为:
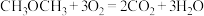 。该电池工作时,负极的电极反应为
。该电池工作时,负极的电极反应为
②以二氧化钛表面覆盖
 为催化剂,可以将
为催化剂,可以将 和
和 直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
直接转化为乙酸。在不同温度下乙酸的生成速率如图所示。在250~300℃时,温度升高而乙酸的生成速率快速降低,原因可能是:
您最近一年使用:0次
名校
8 . 二氧化铈(CeO2)是重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+ 能被萃取剂 TBP 萃取,而Ce3+ 不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是___________ 。
(2)氧化焙烧后的固体产物中含有 CeO2和 CeF4物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为___________ 。传统工艺中用盐酸替代硫酸,其缺点为___________ 。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP CeTBP4++F-,氟洗液中添加 Al3+的作用是
CeTBP4++F-,氟洗液中添加 Al3+的作用是___________ 。
(4)“反萃取”步骤中发生反应的离子方程式为___________ 。
(5)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出CeO2消除CO尾气的化学方程式:___________ 。
(6)CeO2(1-x)中的 Ce为+3、+4 价,测定x的值可判断它们的比例。现取CeO2(1-x)固体0.8280 g,加入足量硫酸和0.0110 mol FeSO4·7H2O充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为___________ 。
②若加入的 FeSO4·7H2O部分变质,会导致测定的 x 值___________ (填“偏高”“偏低”或“不变”)。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+ 能被萃取剂 TBP 萃取,而Ce3+ 不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)氧化焙烧后的固体产物中含有 CeO2和 CeF4物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP
 CeTBP4++F-,氟洗液中添加 Al3+的作用是
CeTBP4++F-,氟洗液中添加 Al3+的作用是(4)“反萃取”步骤中发生反应的离子方程式为
(5)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出CeO2消除CO尾气的化学方程式:
(6)CeO2(1-x)中的 Ce为+3、+4 价,测定x的值可判断它们的比例。现取CeO2(1-x)固体0.8280 g,加入足量硫酸和0.0110 mol FeSO4·7H2O充分溶解,使Ce4+全部被还原成Ce3+,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为
②若加入的 FeSO4·7H2O部分变质,会导致测定的 x 值
您最近一年使用:0次
名校
9 . 气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)以氨和二氧化碳为原料可合成尿素[CO(NH2)2],反应原理为
 ,利用该反应可以在一定程度上减缓温室效应。向2 L恒容密闭容器中充入3 mol NH3和1 mol CO2,使反应进行,保持温度不变,测得CO2的转化率随时间的变化情况如图所示。
,利用该反应可以在一定程度上减缓温室效应。向2 L恒容密闭容器中充入3 mol NH3和1 mol CO2,使反应进行,保持温度不变,测得CO2的转化率随时间的变化情况如图所示。
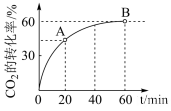
①下列叙述中不能说明该反应达到平衡状态的是_______ (填选项字母)。
A.体系压强不再变化 B.气体密度不再变化
C.气体的体积不再变化 D.NH3的消耗速率和CO2的生成速率之比为2:1
②用CO2的浓度变化表示反应速率,则前20min 反应的平均速率为_______ 。
③按物质的量之比3:1充入NH3和CO2的主要目的是_______ 。
④此温度下,该反应的平衡常数K=_______ (保留2位小数)。
(2)氨不仅应用于化肥生产,也可以应用于能源领域,氨氧燃料电池有性能稳定的独特优势,某研究小组设计的氨氧燃料电池装置如图:

则电极2为_______ 极,电极1的电极反应式为_______ ,A膜为_______ 交换膜 (填 “阳离子”或 “阴离子”)。
(1)以氨和二氧化碳为原料可合成尿素[CO(NH2)2],反应原理为

 ,利用该反应可以在一定程度上减缓温室效应。向2 L恒容密闭容器中充入3 mol NH3和1 mol CO2,使反应进行,保持温度不变,测得CO2的转化率随时间的变化情况如图所示。
,利用该反应可以在一定程度上减缓温室效应。向2 L恒容密闭容器中充入3 mol NH3和1 mol CO2,使反应进行,保持温度不变,测得CO2的转化率随时间的变化情况如图所示。
①下列叙述中不能说明该反应达到平衡状态的是
A.体系压强不再变化 B.气体密度不再变化
C.气体的体积不再变化 D.NH3的消耗速率和CO2的生成速率之比为2:1
②用CO2的浓度变化表示反应速率,则前20min 反应的平均速率为
③按物质的量之比3:1充入NH3和CO2的主要目的是
④此温度下,该反应的平衡常数K=
(2)氨不仅应用于化肥生产,也可以应用于能源领域,氨氧燃料电池有性能稳定的独特优势,某研究小组设计的氨氧燃料电池装置如图:

则电极2为
您最近一年使用:0次
名校
10 . 氨是合成硝酸、铵盐和氮肥的基本原料,氮的氧化物是大气的污染物,请问:
(1)氨的水溶液显弱碱性,其原因为___________ (用离子方程式表示),0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的pH ___________ (填“增大”或“减小”);若加入少量的明矾,溶液中的 的浓度
的浓度 ___________ (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为___________ ,平衡常数表达式为___________ ;若有1mol硝酸铵完全分解,转移的电子数为___________ mol。
(3)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)=2CH3OCH3(g)的反应热为___________ ;
(4)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+ 2CO2(g) CH3OCH3(g)+ 3H2O(g) △H<0
CH3OCH3(g)+ 3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是______ (选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将___________ (填“变大”、“变小”或“不变”)。
(1)氨的水溶液显弱碱性,其原因为
 的浓度
的浓度 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为
(3)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)=2CH3OCH3(g)的反应热为
(4)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+ 2CO2(g)
 CH3OCH3(g)+ 3H2O(g) △H<0
CH3OCH3(g)+ 3H2O(g) △H<0①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将
您最近一年使用:0次



