名校
解题方法
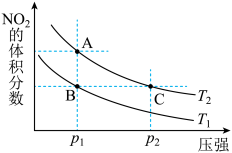
1 . 反应 ,在温度为
,在温度为 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。下列说法正确的是
的体积分数随压强变化曲线如图所示。下列说法正确的是
 ,在温度为
,在温度为 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。下列说法正确的是
的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率: |
| B.A、C两点气体的颜色:A深,C浅 |
C.由状态 到状态 到状态 ,可以用加热的方法 ,可以用加热的方法 |
D. 两点气体的平均相对分子质量: 两点气体的平均相对分子质量: |
您最近一年使用:0次
2023-08-11更新
|
1243次组卷
|
26卷引用:湖南省邵阳市武冈市2022-2023学年高二上学期期中考试化学试题
湖南省邵阳市武冈市2022-2023学年高二上学期期中考试化学试题广东省东莞市二中2020-2021学年上学期高二10月考试化学试题辽宁省大连市普兰店第二中学2020-2021学年高二上学期期中考试化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题江西省名校2021-2022学年高二上学期第一次月考化学试题安徽省淮北市树人高级中学2021-2022学年高二上学期第一次月考化学试题浙江省绍兴鲁迅中学2021-2022学年高二上学期第一次限时训练化学试题江西省新余市第四中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 吉林省松原市长岭县第三中学2021-2022学年高二上学期第三次考试化学试题湖北省宜城市第三高级中学2021-2022学年高二上学期期中考试化学试卷题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题大庆市肇州县肇州中学2021-2022学年高二上学期第二次月考化学试题广东省江门市第一中学2022-2023学年高二上学期第一次月考化学试题河南省平顶山市汝州第一高级中学2022-2023学年高二10月月考化学试题(已下线)第06讲 化学反应速率与化学平衡的图像-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)湖南师范大学附属中学2022-2023学年高一下学期期末考试化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题山东学情2023-2024学年高二上学期10月质量检测(人教版)化学试题四川省仁寿第一中学校南校区2023-2024学年高二上学期10月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题天津市第四十七中学2023-2024学年高二上学期11月期中考试化学试题
名校
2 . 以下图像和叙述错误的是
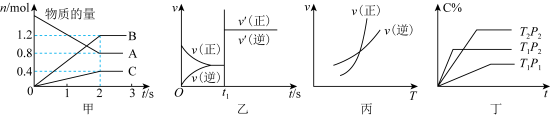
| A.图甲:该图像表示的反应方程式为2A=3B+C,反应速率v(A)=0.4mol/(L•s) |
B.图乙:某温度下发生反应: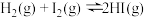 ,t1时刻改变的条件可以是加入催化剂 ,t1时刻改变的条件可以是加入催化剂 |
| C.图丙:对图中反应升高温度,该反应平衡常数增大 |
D.图丁:对于反应: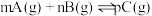 , , 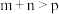 |
您最近一年使用:0次
2023-08-21更新
|
1001次组卷
|
13卷引用:湖南省邵阳市武冈市2023-2024学年高二上学期期中考试化学试题
湖南省邵阳市武冈市2023-2024学年高二上学期期中考试化学试题福建省泉州市等4校2022-2023学年高二上学期11月期中考试化学试题广东省广州市华侨中学2023-2024学年高一上学期10月月考化学试题河北省保定市定州中学2023-2024学年高二上学期9月月考化学试题重庆市万州第二高级中学教育集团2023-2024学年高二上学期10月月考化学试题陕西省咸阳市武功县普集高级中学2023-2024学年高二上学期11月期中考试化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题湖南省长长沙市德成学校2023-2024学年高二上学期11月期中考试化学试题广西桂林市第十一中学2023-2024学年高二上学期11月期中化学试题陕西省宝鸡市扶风县法门高中2023-2024学年高二上学期期中考试化学试题山东省菏泽市郓城县第一中学2023-2024学年高二上学期第一次阶段测试化学试题新疆维吾尔自治区阿克苏地区第一中学2023-2024学年高二上学期期中考试化学试卷江西省南昌十九中2023-2024学年高二上学期期中考试化学试卷
真题
名校
3 . 反应C2H6(g) C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
| A.增大容器容积 | B.升高反应温度 |
| C.分离出部分氢气 | D.等容下通入惰性气体 |
您最近一年使用:0次
2019-06-24更新
|
5299次组卷
|
24卷引用:湖南省邵阳市新邵县第二中学2023-2024学年高二上学期期中考试化学试卷
湖南省邵阳市新邵县第二中学2023-2024学年高二上学期期中考试化学试卷2019年高考海南卷化学试题【全国百强校】河南省洛阳市第一高级中学2018-2019学年高二9月月考化学试题2020届高考化学小题狂练(全国通用版)专练14 化学平衡新疆维吾尔自治区和田地区2019-2020学年高二上学期期中考试化学试题(已下线)2019年12月25日《每日一题》人教版(选修4)—— 影响化学平衡的因素黑龙江省大庆十中2020届高三上学期第二次月考理综化学试题专题2.2 化学反应速率和化学平衡(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)【新东方】 2020-2河北正定中学2019-2020学年高一下学期摸底考试化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)福建省泉州第十六中学2020-2021学年高二上学期期中考试化学(选考班)试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第一次月考化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期中考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期开学考试化学试题黑龙江省哈尔滨工业大学附属中学2020-2021学年度高二下学期期末考试化学试题(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖南师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第一中学2022-2023学年高二10月月考化学试题山东省济南市天桥区黄河双语实验学校2021-2022学年高二上学期10月月考化学试题四川省资阳中学2022-2023学年高二上学期期末考试化学试题(已下线)专题15 化学反应速率和化学平衡(已下线)2019年高考海南卷化学试题变式题(单选题)
4 . 对已经达到化学平衡的反应: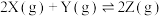 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是
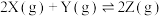 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
您最近一年使用:0次
2022-11-02更新
|
740次组卷
|
97卷引用:湖南省邵阳市洞口县第四中学2019-2020学年高二上学期期中考试化学试题
湖南省邵阳市洞口县第四中学2019-2020学年高二上学期期中考试化学试题(已下线)2010—2011学年浙江省杭州学军中学高二下学期期中考试化学试卷(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)2011-2012学年山东省鲁北中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷(已下线)2011-2012学年云南省玉溪一中高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年江苏省南京三中高二下学期期中考试化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014秋安徽省淮北师范大学附属实验中学高二上学期期中化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷2015-2016学年陕西省澄城县寺前中学高一下学期期中考试化学试卷(已下线)同步君 人教版 选修4 第2章 第3节 化学平衡状态2016-2017学年湖北省襄阳五中高二上开学考试化学试卷2016-2017学年河北省博野中学高二上学期第二次月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷2016-2017学年甘肃省民乐一中高二上10月月考化学试卷2016-2017学年山东省桓台二中高二12月检测化学试卷辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高二上学期第一次月考化学试题甘肃省岷县一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题四川省宜宾市第四中学2018-2019学年高二上学期期中考试理科综合化学试题高二人教版选修4 第二章 第三节 化学平衡河北省承德市第一中学2018-2019学年高二上学期第三次月考化学试题甘肃省镇原县孟坝中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区沙雅县第二中学2018-2019学年高二上学期期中考试化学试题河南省永城市实验高级中学2018-2019学年高二上学期期中考试化学试题辽宁省大连渤海高级中学2018-2019学年高二下学期期中考试化学试题上海市华东师范大学附属天山学校2018-2019学年高一第二学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题甘肃省张掖市山丹县第一中学2019-2020学年上学期9月月考--高二化学江西省宜春九中(外国语学校)2019-2020学年高二上学期期中考试化学试题吉林省蛟河市朝鲜族中学校2019-2020学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题新疆沙雅县第二中学2019-2020学年高二上学期期中考试化学试题贵州省毕节市实验高级中学2018-2019学年高二上学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二上学期期末考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题陕西省延安市吴起高级中学2019-2020学年高一下学期第四次质量检测(期末)化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题河北省张家口宣化一中2020-2021学年高二上学期12月月考化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题湖北省十堰市2020-2021学年高二上学期期末考试化学试题广东省惠州市2020-2021学年高二上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题广东省惠州市2020-2021学年高二上学期期末质量监测化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题河南省开封市五县2020-2021学年高二上学期期末考试化学试题选择性必修1(SJ)专题2第三单元 化学平衡的移动山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省随州市洛平许济四市联盟2022-2023学年高三上学期第一次质量检测化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题河南省灵宝市第五高级中学2021-2022学年高二下学期第一次月考化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题广东省阳江市高新区2022-2023学年高二上学期1月期末考试化学试题作业(十二) 压强对化学平衡的影响 勒·夏特列原理
名校
解题方法
5 . CO和H2合成乙醇发生如下反应:
反应Ⅰ:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1= −128.8 kJ·mol-1
反应Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2= −41.8 kJ·mol-1
向一恒容密闭容器中投入一定量的CO和H2发生上述反应,CO的平衡转化率与温度、投料比α[α = ]的关系如图所示。
]的关系如图所示。
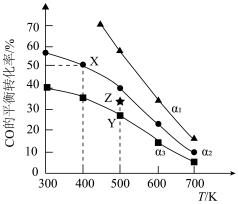
下列有关说法正确的是
反应Ⅰ:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1= −128.8 kJ·mol-1
反应Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2= −41.8 kJ·mol-1
向一恒容密闭容器中投入一定量的CO和H2发生上述反应,CO的平衡转化率与温度、投料比α[α =
 ]的关系如图所示。
]的关系如图所示。
下列有关说法正确的是
| A.α1<α2 |
| B.在400 K、α2=2时,反应Ⅰ的平衡常数K=0.25 |
| C.在500 K、投料比为α3条件下,增大压强可使CO的平衡转化率从Y点到Z点 |
| D.为同时提高CO的平衡转化率和CH3CH2OH的产率可采用的反应条件为低温、低压 |
您最近一年使用:0次
2022-04-06更新
|
702次组卷
|
8卷引用:湖南省邵阳市第一中学2023届高三第七次月考化学试题
湖南省邵阳市第一中学2023届高三第七次月考化学试题江苏省连云港市2022届高三第二次调研考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(江苏专用)(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)湖南省永州市第一中学2022-2023学年高三第七次月考化学试题湖南省株洲市第二中学2023届高三第七次月考化学试题江苏省苏北三市2022-2023学年高二上学期阶段调研测试化学试题
名校
解题方法
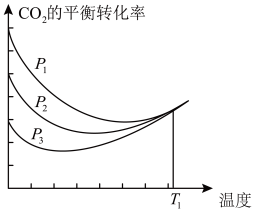
6 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1237次组卷
|
10卷引用:湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题
湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)河北省武邑中学2021届高考七模化学试题黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷
名校
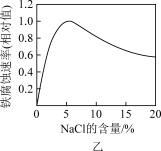
7 . 根据下列图示所得出的结论不正确的是
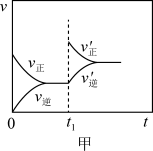
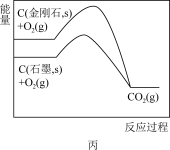
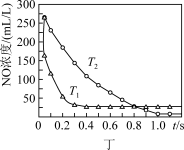




A.图甲表示2SO2(g)+O2(g) 2SO3(g) △H<0,t1时改变的条件是增大体系的压强 2SO3(g) △H<0,t1时改变的条件是增大体系的压强 |
| B.图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小 |
| C.图丙说明石墨转化为金刚石的反应的△H<0 |
D.图丁是一定条件下发生反应:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)此过程△H<0 4N2(g)+6H2O(g)此过程△H<0 |
您最近一年使用:0次
2022-05-10更新
|
367次组卷
|
8卷引用:湖南省邵阳市武冈市2022-2023学年高三上学期期中考试化学试题
湖南省邵阳市武冈市2022-2023学年高三上学期期中考试化学试题北京市通州区2020届高三第一次模拟考试化学试题湖南省岳阳市2019-2020学年高二下学期期末考试化学试题河北省武邑中学2021届高三二模化学试题(已下线)第七章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测重庆市第七中学校2022届高三第二次月考化学试题湖南省岳阳市平江县2022届高三下学期教学质量监测(三)化学试题(已下线)微专题38 新情景下的综合图象与突破-备战2023年高考化学一轮复习考点微专题
8 . CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为CO(g)+2H2(g)  CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
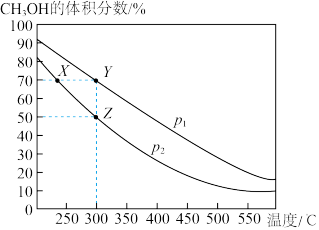
 CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
| A.p1<p2 | B.该反应的ΔH>0 |
| C.平衡常数:K(X)=K(Y) | D.在Z点时,CO转化率为75% |
您最近一年使用:0次
2022-04-11更新
|
345次组卷
|
23卷引用:湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题
湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷云南省民族大学附属中学2019届高三上学期期中考试化学试题内蒙古北方重工业集团有限公司第三中学2019-2020学年高二10月月考化学试题湖北省武汉市汉阳一中2019-2020学年高二9月月考化学试题人教版选修四2019-2020学年高二上学期期末复习化学综合训练福建省漳州市龙海市第二中学2020届高三上学期第二次月考化学试题甘肃省张掖市第二中学2020届高三上学期11月月考化学试题江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题河北省衡水中学2020届高三上学期第四次调研考试化学试题【省级联考】浙江省2019—2020学年普通高校招生选考科目化学模拟试题(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题河南省实验中学2020-2021学年高二上学期期中考试化学试题江西省景德镇一中2020-2021学年高二上学期期中考试化学(2班)试题福建省龙海第二中学2021届高三上学期第三次月考试题(1月)化学试题北京市通州区2021届高三一模化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题山西省运城市芮城中学2021-2022学年高二上学期12月月考化学试题广东省汕头市金山中学2021-2022学年高二上学期期末考试化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题广东省肇庆市第一中学2022-2023学年高二上学期期中考试化学试题山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题
9 . 某温度下,在一个2L的密闭容器中,加入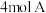 和
和 进行如下反应:
进行如下反应: ,反应2min后达到平衡,测得生成
,反应2min后达到平衡,测得生成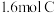 ,下列说法正确的是
,下列说法正确的是
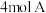 和
和 进行如下反应:
进行如下反应: ,反应2min后达到平衡,测得生成
,反应2min后达到平衡,测得生成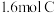 ,下列说法正确的是
,下列说法正确的是A.前 的平均反应速率为 的平均反应速率为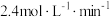 | B.此时A的平衡转化率是80% |
| C.增大该体系的压强,平衡向逆方向移动 | D.该温度下平衡常数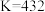 |
您最近一年使用:0次
2022-09-13更新
|
338次组卷
|
2卷引用:湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题
名校
10 . 下列图示与对应叙述相符的是
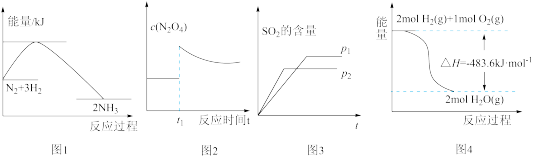

| A.图1反应达平衡后,升高温度,平衡常数K值减小 |
B.图2表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
C.图3表示可逆反应“2SO2+O2 2SO3”中SO2的含量与压强的关系,且P2>P1 2SO3”中SO2的含量与压强的关系,且P2>P1 |
| D.图4表示H2与O2发生反应过程中的能量变化,则H2的燃烧热ΔH=-241.8kJ•mol-1 |
您最近一年使用:0次
2022-09-27更新
|
328次组卷
|
3卷引用:湖南省邵阳市第二中学2022-2023学年高二上学期期中考试化学试题



