1 . 在一密闭容器中,物质 发生三个脱水的竞争反应:①
发生三个脱水的竞争反应:①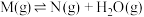

②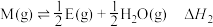 ③
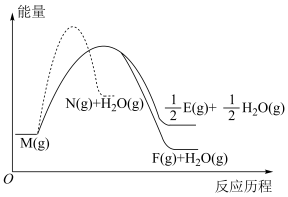
③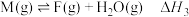 反应历程如图所示。相同条件下,下列说法正确的是
反应历程如图所示。相同条件下,下列说法正确的是
 发生三个脱水的竞争反应:①
发生三个脱水的竞争反应:①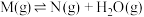

②
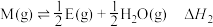 ③
③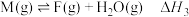 反应历程如图所示。相同条件下,下列说法正确的是
反应历程如图所示。相同条件下,下列说法正确的是
| A.由图可知,物质M比物质N稳定 |
| B.反应①比反应②和③更快达到化学平衡 |
C.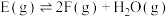 的反应热 的反应热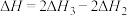 |
| D.平衡后压缩容器,物质E的物质的量不变 |
您最近一年使用:0次
2023·山东青岛·三模
解题方法
2 . 已知反应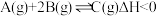 。在体积可变的密闭容器中,按
。在体积可变的密闭容器中,按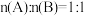 充入反应物进行反应,A的平衡转化率与温度、压强关系如图所示。下列说法正确的是
充入反应物进行反应,A的平衡转化率与温度、压强关系如图所示。下列说法正确的是
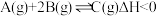 。在体积可变的密闭容器中,按
。在体积可变的密闭容器中,按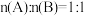 充入反应物进行反应,A的平衡转化率与温度、压强关系如图所示。下列说法正确的是
充入反应物进行反应,A的平衡转化率与温度、压强关系如图所示。下列说法正确的是
A.温度: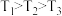 |
B.平均摩尔质量: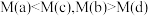 |
C.a点的分压平衡常数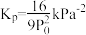 |
D.d点: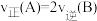 |
您最近一年使用:0次
2023-05-27更新
|
1025次组卷
|
5卷引用:选择题11-16
(已下线)选择题11-16山东省青岛市2023届高三第三次适应性检测化学试题考点巩固卷08 化学反应速率与化学平衡(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第28讲化化学平衡的移动及反应进行的方向(已下线)提升练05 化学平衡常数的计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
3 . 已知反应:CO(g)+3H2(g)  CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为
CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为 )。下列有关说法正确的是
)。下列有关说法正确的是
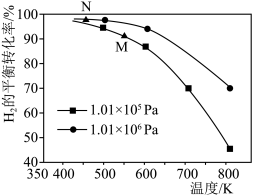
 CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为
CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为 )。下列有关说法正确的是
)。下列有关说法正确的是 
| A.上述反应逆反应的ΔH > 0 |
| B.N点时的反应速率一定比M点的快 |
| C.降低温度,H2的转化率可达到100% |
| D.工业上用此法制取甲烷应采用更高的压强 |
您最近一年使用:0次
名校
4 . 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
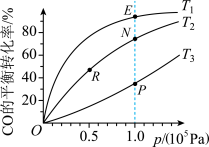
 CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
| A.温度:T1>T2>T3 |
| B.正反应速率:v(E)>v(P)、v(N)>v(R) |
| C.平衡常数:K(E)>K(P)、K(N)>K(R) |
| D.平均摩尔质量:M(E)>M(P)、M(N)>M(R) |
您最近一年使用:0次
2023-04-11更新
|
687次组卷
|
3卷引用:广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题
名校
5 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是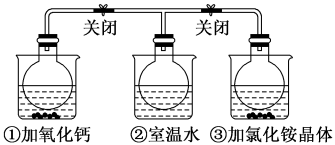
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1133次组卷
|
23卷引用:广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题
广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
名校
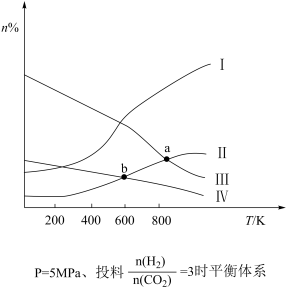
6 . 在固定容积的密闭容器中,按 与
与 的物质的量之比为1∶3进行投料,发生反应
的物质的量之比为1∶3进行投料,发生反应 ,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表
,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表 。下列说法正确的是
。下列说法正确的是
 与
与 的物质的量之比为1∶3进行投料,发生反应
的物质的量之比为1∶3进行投料,发生反应 ,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表
,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表 。下列说法正确的是
。下列说法正确的是
A.图中曲线交点a、b对应的平衡常数 |
B.图中曲线交点b对应的 转化率为40% 转化率为40% |
| C.平衡时,向体系中加入氢气,氢气转化率变大 |
D.若其他条件相同,甲为恒温恒容,乙为绝热恒容,达到平衡时 产率:甲>乙 产率:甲>乙 |
您最近一年使用:0次
2022-03-24更新
|
586次组卷
|
6卷引用:广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题
广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题(已下线)2022年河北省新高考测评卷(七)(已下线)2022年湖南卷高考真题变式题(11-14)天津市第二十五中学2022 -2023学年高二上学期期中考试化学试题江西省南昌市第二中学2022-2023学年高三上学期第四次考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题
7 . 氮和硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g) 2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):
2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):
2NO(g)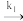 N2O2(g)E1=82kJ/molv=k1c2(NO)
N2O2(g)E1=82kJ/molv=k1c2(NO)
N2O2(g)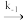 2NO(g)E-1=205kJ/molv=k-1c(N2O2)
2NO(g)E-1=205kJ/molv=k-1c(N2O2)
N2O2(g)+O2(g) 2NO2(g)E2=82kJ/molv=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ/molv=k2c(N2O2)·c(O2)
2NO2(g)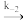 N2O2(g) +O2(g)E-2=72kJ/molv=k-2c2(NO2)
N2O2(g) +O2(g)E-2=72kJ/molv=k-2c2(NO2)
则2NO(g) N2O2(g)△H1=
N2O2(g)△H1=_______ kJ·mol-1,其平衡常数K与上述速率常数k1、k-1的关系式为K=_______ 。2NO(g)+O2(g) 2NO2(g)△H=
2NO2(g)△H=_______ kJ·mol-1。
(2)已知反应NO2(g)+SO2(g) NO(g)+SO3(g)△H<0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lgp(NO2)和lgp(SO3)两个压强对数的关系如图所示,实验初始时体系中的p(NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
NO(g)+SO3(g)△H<0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lgp(NO2)和lgp(SO3)两个压强对数的关系如图所示,实验初始时体系中的p(NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
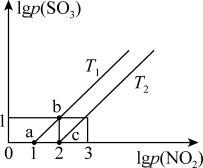
①a、b两点体系压强pa与pb的比值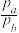 =
=_______ ;同一温度下图象呈线性变化的理由是_______ 。
②温度为T1时化学平衡常数KP=_______ ,T1_______ T2(填“>”“<”或者“=”)。
(1)2NO(g)+O2(g)
 2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):
2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):2NO(g)
 N2O2(g)E1=82kJ/molv=k1c2(NO)
N2O2(g)E1=82kJ/molv=k1c2(NO)N2O2(g)
 2NO(g)E-1=205kJ/molv=k-1c(N2O2)
2NO(g)E-1=205kJ/molv=k-1c(N2O2)N2O2(g)+O2(g)
 2NO2(g)E2=82kJ/molv=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ/molv=k2c(N2O2)·c(O2)2NO2(g)
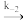 N2O2(g) +O2(g)E-2=72kJ/molv=k-2c2(NO2)
N2O2(g) +O2(g)E-2=72kJ/molv=k-2c2(NO2)则2NO(g)
 N2O2(g)△H1=
N2O2(g)△H1= 2NO2(g)△H=
2NO2(g)△H=(2)已知反应NO2(g)+SO2(g)
 NO(g)+SO3(g)△H<0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lgp(NO2)和lgp(SO3)两个压强对数的关系如图所示,实验初始时体系中的p(NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
NO(g)+SO3(g)△H<0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lgp(NO2)和lgp(SO3)两个压强对数的关系如图所示,实验初始时体系中的p(NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
①a、b两点体系压强pa与pb的比值
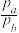 =
=②温度为T1时化学平衡常数KP=
您最近一年使用:0次
2021-03-13更新
|
779次组卷
|
6卷引用:广东省韶关市2021届高三综合测试化学试题
广东省韶关市2021届高三综合测试化学试题(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)河南省实验中学2021届高三5月第四次模拟考试理综化学试题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
8 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
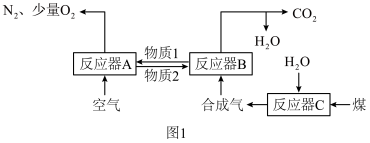
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
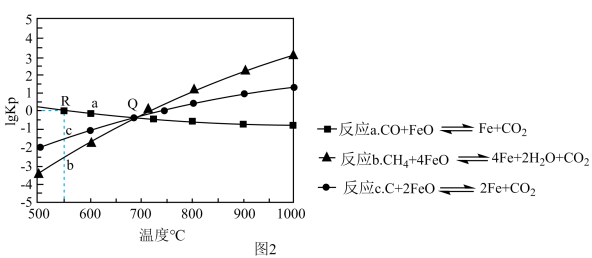
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
292次组卷
|
5卷引用:广东省2020届高三调研考试理科综合化学试卷(一)
名校
9 . 一定温度下将CaCO3放入密闭真空容器中,反应CaCO3(s) CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
 CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是| A.平衡向左移动 | B.压强不变 |
| C.平衡常数不变 | D.固体总质量不变 |
您最近一年使用:0次
2020-04-28更新
|
295次组卷
|
4卷引用:广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题山东省日照市2018-2019学年高二上学期期末模块考试化学试题(已下线)2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷01(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】
名校
解题方法
10 . 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
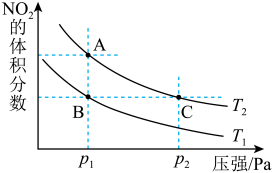
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1049次组卷
|
9卷引用:广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题
广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题



