名校
解题方法
1 . 将玉米秸秆进行热化学裂解可制备出以CO、 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
(1)已知:几种常见共价键的键能如下表所示:
由此可计算反应 的焓变
的焓变
___________ kJ⋅mol 。
。
(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是___________(填标号)。
(3) 和
和 合成乙醇的反应为
合成乙醇的反应为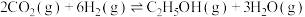 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。
___________  (填“>、<”或“=”,下同)。判断依据是
(填“>、<”或“=”,下同)。判断依据是___________ 。
②a、b两点的平衡常数
___________  。
。
③已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
___________ J⋅mol 。从图中信息获知催化效率较高的催化剂是
。从图中信息获知催化效率较高的催化剂是___________ (填“m”或“n”)。
 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。(1)已知:几种常见共价键的键能如下表所示:
| 共价键 | C-H | C-O | C≡O | H-H | O-H |
键能(kJ⋅mol ) ) | 413 | 358 | 839 | 436 | 467 |
 的焓变
的焓变
 。
。(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是___________(填标号)。
| A.体系温度不再发生变化时,反应达到化学平衡状态 |
B.体系中若 和 和 的物质的量之比达到2∶1,则反应已达到平衡 的物质的量之比达到2∶1,则反应已达到平衡 |
C.加入催化剂,可以提高 的平衡产率 的平衡产率 |
| D.其它条件不变,增大CO的浓度,能提高H2的平衡转化率 |
(3)
 和
和 合成乙醇的反应为
合成乙醇的反应为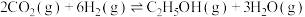 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。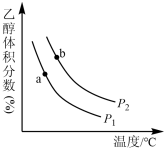

 (填“>、<”或“=”,下同)。判断依据是
(填“>、<”或“=”,下同)。判断依据是②a、b两点的平衡常数

 。
。③已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
 。从图中信息获知催化效率较高的催化剂是
。从图中信息获知催化效率较高的催化剂是
您最近一年使用:0次
名校
解题方法
2 . 在恒温恒压下,向密闭容器中充入4mol  和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是
 和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是A.若反应开始时容器体积为2L,则 |
B.若把条件“恒温恒压”改为“恒压恒容”,则平衡后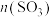 大于1.4mol 大于1.4mol |
C.2min后,向容器中再通入一定量的 气体,重新达到平衡时 气体,重新达到平衡时 的含量变小 的含量变小 |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于Q kJ |
您最近一年使用:0次
名校
3 . 恒温恒容,可逆反应N2O4(g) 2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
 2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是| A.NO2的体积分数增大 | B.达新平衡后平衡体系压强比原平衡大 |
| C.平衡正向移动 | D.达新平衡后N2O4转化率降低 |
您最近一年使用:0次
名校
4 . 下列有关对应图像的说法正确的是

A.据①知,某温度下,平衡状态由A变到B时,平衡常数 |
B.据平衡常数的负对数(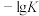 )—温度(T)图像②知,30℃时,B点对应状态的 )—温度(T)图像②知,30℃时,B点对应状态的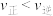 |
C.由 的稳定性与溶液pH的关系可知图③中 的稳定性与溶液pH的关系可知图③中 |
D.图④所示体系中气体平均摩尔质量: , , |
您最近一年使用:0次
名校
5 . 一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

 xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s) ΔH<0在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是
| A.x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是增大反应物的浓度或降温 |
| D.t1~t2、t2~t3平衡常数相等,且K=4 |
您最近一年使用:0次
名校
解题方法
6 . 研究氮氧化物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.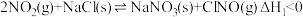
Ⅱ.
①反应: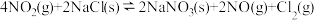 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正)___________  (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。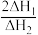 的数值范围是
的数值范围是___________ (填序号)。
A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时
___________ mol,Ⅱ的压强平衡常数
___________ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(2)CO还原氮氧化物的反应如下: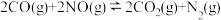
 。
。
①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。
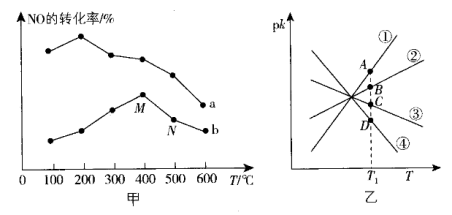
在催化剂作用下,图中M点___________ (填“达到了”或“未达到”)平衡状态。温度高于400℃,NO转化率降低的原因可能是___________ 。
②实验测得 (
( 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示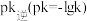 随温度变化的是
随温度变化的是___________ (填序号)升高温度,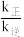
___________ (填“增大”“减小”或“不变”)图中 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
___________ L/mol。
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”)。
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.
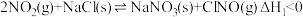
Ⅱ.

①反应:
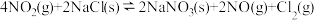 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正) (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。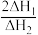 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol
 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时

 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(2)CO还原氮氧化物的反应如下:
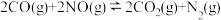
 。
。①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。

在催化剂作用下,图中M点
②实验测得
 (
( 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示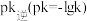 随温度变化的是
随温度变化的是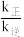
 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将
您最近一年使用:0次
名校
7 . 可逆反应aA(g)+bB(s)⇌cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是
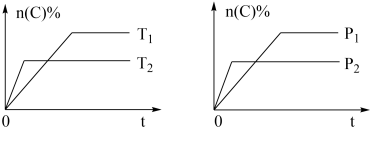

| A.升高温度,平衡向逆反应方向移动 |
| B.使用催化剂,C的物质的量分数增加 |
| C.化学方程式系数a>c+d |
| D.达到平衡后,P1条件V逆反应速率大于P2条件下V正反应速率 |
您最近一年使用:0次
8 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g) CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1
写出以甲醇为原料制取氢气的热化学方程式___________ 。
(2)理论上,能提高H2平衡产率的措施有___________ (写出一条即可)。
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式___________ 。
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是___________ 。

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。
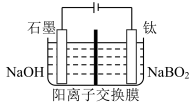
①钛电极的电极反应式是___________ ;
②电解过程中,阴极区溶液pH___________ 。(填“增大”“减小”或“不变”)
I.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
CH3OH(g)
 CO(g)+2H2(g) △H=+91 kJ·mol-1
CO(g)+2H2(g) △H=+91 kJ·mol-1CO(g)+H2O(g)
 CO2(g)+H2 (g) △H=-4lkJ·mol-1
CO2(g)+H2 (g) △H=-4lkJ·mol-1写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高H2平衡产率的措施有
II.储存氢气
硼氢化钠(NaBH4) 是研究最广泛的储氢材料之一;
已知: i.B的电负性为2.0 H的电负性为2.1
ii.25℃下NaBH4 在水中的溶解度为55g,NaBO2在水中的溶解度为0.28g
(3)向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(NaBO2) 和氢气。写出该反应的化学方程式
(4)在研究浓度对催化剂Ru/NGR 活性的影响时,发现B 点后(见下图)增加NaBH4的浓度,制氢速率反而下降,推断可能的原因是

(5)用惰性电极电解NaBO2 溶液可制得NaBH4, 实现物质的循环使用,制备装置如图所示。

①钛电极的电极反应式是
②电解过程中,阴极区溶液pH
您最近一年使用:0次
9 . 向相同容积的甲、乙两容器中分别充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)=2SO3(g) △H<0。若甲容器保持恒温恒容,乙容器保持恒温恒压,分别达到平衡。乙容器中平衡时生成SO3为1.6 mol,同时放出热量Q kJ。下列说法正确的是
| A.平衡时,反应放出的热量:甲>乙 |
| B.平衡时,O2的质量:甲<乙 |
| C.乙容器若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO2)大于2.4 mol |
| D.平衡时,向乙容器中再通入一定量的SO3气体,重新达到平衡时,SO2的百分含量升高 |
您最近一年使用:0次
名校
10 . 纳米二氧化钛催化剂可用于工业上合成甲醇: ,按投料比
,按投料比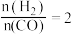 将
将 与
与 充入
充入 恒容密闭容器中,在一定条件下发生反应,测得
恒容密闭容器中,在一定条件下发生反应,测得 的平衡转化率与温度、压强的关系如图所示。下列说法错误的是
的平衡转化率与温度、压强的关系如图所示。下列说法错误的是

 ,按投料比
,按投料比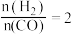 将
将 与
与 充入
充入 恒容密闭容器中,在一定条件下发生反应,测得
恒容密闭容器中,在一定条件下发生反应,测得 的平衡转化率与温度、压强的关系如图所示。下列说法错误的是
的平衡转化率与温度、压强的关系如图所示。下列说法错误的是
A. , ,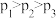 |
B.达到平衡后,再按照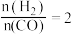 加入气体,平衡后 加入气体,平衡后 的体积分数增大 的体积分数增大 |
| C.M点平衡后,恒温恒容下,向容器中再加入2molCH3OH、3molCO,则平衡不移动 |
D. 、 、 压强下,Q点对应的 压强下,Q点对应的 |
您最近一年使用:0次



