11-12高二·陕西宝鸡·阶段练习
1 . 自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)⇌SiF4(g)+ 2H2O(g)+148.9 kJ。根据题意完成下列填空:
(1)在地壳深处容易有_____________ 气体逸出,在地壳浅处容易有___________ 沉积。
(2)如果上述反应的平衡常数K值变大,该反应_____________ (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________ (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为____________ 。
(1)在地壳深处容易有
(2)如果上述反应的平衡常数K值变大,该反应
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为
您最近一年使用:0次
2020-03-20更新
|
581次组卷
|
7卷引用:2012-2013学年陕西省宝鸡中学高二第一次月考化学试卷
名校
解题方法
2 . 恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)⇌C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为__ mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__ mol
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=__ ,y=__ 。平衡时,B的物质的量__ (填编号)。
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是__ 。
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较__ (填编号)。作出此判断的理由是__ 。
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
您最近一年使用:0次
2020-03-05更新
|
282次组卷
|
4卷引用:陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题
陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高二上学期期末考试化学(已下线)专题26 “等效平衡”及其应用-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题
3 . 现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中 C 的质量分数也减小,则:
(1)该反应的正反应为_____ 热反应,且 m+n_____ p(填“>”“=”“<”)。
(2)减压时,A 的质量分数_____ 。(填“增大”“减小”或“不变”,下同)
(3)恒温恒容时,若加入 B,则 A 的转化率_____ ,B 的转化率_____ 。
(4)若升高温度,则平衡时 c(B):c(C)的值将_____ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_____ 。
(6)保持体积不变,若 B 是有色物质,A、C 均无色,则加入 C 时混合气体颜色_ (填“变深”“变浅”或“不变”,下同)。
(7)若 B 是有色物质,压缩体积为原来的一半,则混合气体颜色_____ ,而维持容器内压强不变,充入氖气时,混合物颜色_____ 。
(1)该反应的正反应为
(2)减压时,A 的质量分数
(3)恒温恒容时,若加入 B,则 A 的转化率
(4)若升高温度,则平衡时 c(B):c(C)的值将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)保持体积不变,若 B 是有色物质,A、C 均无色,则加入 C 时混合气体颜色
(7)若 B 是有色物质,压缩体积为原来的一半,则混合气体颜色
您最近一年使用:0次
名校
4 . 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g) CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__ ;根据图,升高温度,K值将__ (填“增大”、“减小”或“不变”)。
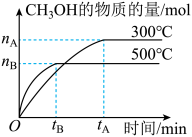
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__ (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__ (填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是____ 。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时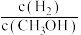 减小
减小
 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。(1)该反应的平衡常数表达式K=

(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是
(3)判断该可逆反应达到化学平衡状态的标志是
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时
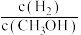 减小
减小
您最近一年使用:0次
2019-11-26更新
|
647次组卷
|
22卷引用:陕西省渭南市华州区咸林中学2023-2024学年高二上学期第二次月考化学试卷
陕西省渭南市华州区咸林中学2023-2024学年高二上学期第二次月考化学试卷2015-2016学年湖南省常德一中高二上学期期末理化学试卷2017届广东省韶关市六校高三上10月联考化学试卷辽宁省瓦房店市高级中学2016-2017学年高一6月基础知识竞赛化学试题山西省朔州市第一中学2017-2018学年高二8月月考化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高二上学期第一次月考理科综合化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题内蒙古自治区通辽市开鲁县第一中学2019-2020学年高一下学期期末考试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学试题(普通版)(已下线)第10单元 化学反应速率与化学平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题安徽省安庆市九一六学校2020-2021学年高二3月月考化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题新疆疏勒县实验学校2021-2022学年高二上学期期末考试化学试题
名校
5 . 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: 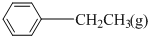

 。
。
(1)已知:
计算上述反应的ΔH=___________ kJ·mol-1.该反应在___________ 条件下能自发进行。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________ 。
(3)L(L1、L2),X可分别代表压强或温度。下图表示L一定时乙苯的平衡转化率随X的变化关系。

①X代表的物理量是___________ ;
②判断L1、L2的大小关系:___________ 。
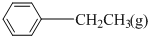

 。
。(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的ΔH=
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实
(3)L(L1、L2),X可分别代表压强或温度。下图表示L一定时乙苯的平衡转化率随X的变化关系。

①X代表的物理量是
②判断L1、L2的大小关系:
您最近一年使用:0次
名校
6 . 反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是
Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是__________ (填增大、不变、减小,以下相同)。②将容器的体积缩小一半,其正反应速率__________ ,其逆反应速率__________ 。③保持压强不变,充入N2使容器的体积增大,其正反应速率__________ 。
 Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是
Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是
您最近一年使用:0次
名校
7 . 可逆反应3A(g) 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①___ ;
b.若B、C都不是气体,气体的平均相对分子质量②____ ;
c.若B是气体,C不是气体,气体的平均相对分子质量③___ ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④___ 态,C是⑤___ 态。
 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①
b.若B、C都不是气体,气体的平均相对分子质量②
c.若B是气体,C不是气体,气体的平均相对分子质量③
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④
您最近一年使用:0次
2016-12-09更新
|
561次组卷
|
9卷引用:2016-2017学年陕西省宝鸡市岐山县高二上期中理化学卷
2016-2017学年陕西省宝鸡市岐山县高二上期中理化学卷(已下线)2011-2012学年安徽省六安三中高二上学期期末考试化学A卷(已下线)2012-2013学年江西省吉安二中高二第二次(12月)月考化学试卷2014-2015学年天津市宝坻区四校高二11月联考化学试卷甘肃省武威第五中学2016-2017学年高二下学期第二次月考化学试题山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题江西省宜春市上高二中2019-2020学年高二上学期第二次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高二上学期第二次月考化学试题(已下线)BBWYhjhx1104.pdf
名校
8 . 300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应3A(g)+B(g) 2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。
2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为:K=__________________ ;已知K300℃<K350℃,则△H______ 0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为_____________ ,D的平均反应速率为____________ ;
(3)若温度不变,缩小容器容积,则A的转化率___________ (填“增大”、“减小”或“不变”),原因是___________ ;
 2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。
2C(g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D。(1)300℃时,该反应的平衡常数表达式为:K=
(2)在2min末时,B的平衡浓度为
(3)若温度不变,缩小容器容积,则A的转化率
您最近一年使用:0次
2016-12-09更新
|
118次组卷
|
5卷引用:2015-2016学年陕西省镇安中学高二上期中质检化学试卷



