1 . 甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺CH3NH2的反应为是一个可逆的过程,以甲醇蒸气、氨气为原料合成,另一产物为水蒸气。已知该反应中相关化学键的键能数据如下:
则该反应的热化学方程式为:_______
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
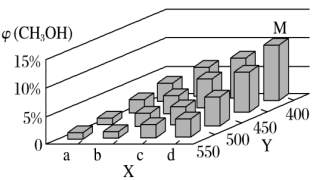
①平衡时,M点CH3OH的体积分数为10%,求该反应在400℃时的平衡常数K=_______ 。
②某同学认为上图中X轴表示压强,你认为他判断的理由是_______ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式_______ 。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在P0MPa、T℃的条件下发生反应:I2(g)+H2(g) 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
①该反应进行到6min时体系内H2的分压为_______ 。(分压=总压×物质的量分数)
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线。_______
(1)制取甲胺CH3NH2的反应为是一个可逆的过程,以甲醇蒸气、氨气为原料合成,另一产物为水蒸气。已知该反应中相关化学键的键能数据如下:
| 共价键 | C—O | H—O | N—H | C—N |
| 键能/(kJ/mol) | 351 | 463 | 393 | 293 |
则该反应的热化学方程式为:
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0在一定条件下,将1molCO和2molH2通入一个3L的密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,求该反应在400℃时的平衡常数K=
②某同学认为上图中X轴表示压强,你认为他判断的理由是
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在P0MPa、T℃的条件下发生反应:I2(g)+H2(g)
 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应进行到6min时体系内H2的分压为
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线。

您最近一年使用:0次
2020-12-24更新
|
155次组卷
|
2卷引用:广东省中山纪念中学2020-2021学年高二上学期第一次段考化学试题
名校
解题方法
2 . 在一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196kJ·mol-1。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196kJ·mol-1。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)上述反应达到平衡时反应放出的热量为___ 。
(2)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1___ T2(填“>”“<”或“=”)。

 2SO3(g) ΔH=-196kJ·mol-1。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196kJ·mol-1。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)上述反应达到平衡时反应放出的热量为
(2)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1

您最近一年使用:0次
3 . 建设生态美丽中国,减少雾霾等不利天气是重要内容,白磷燃烧、汽车尾气的排放都能造成雾霾天气。
I.已知白磷(P4)及其燃烧产物P4O10的结构如图所示。
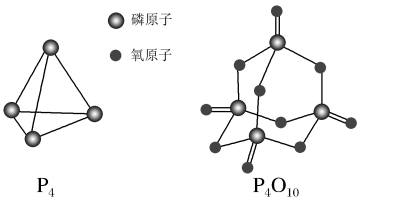
下列说法正确的是___
A.白磷通常保存在水中
B.白磷分子中的键角为109°28'
C.P4O10常用作干燥剂,它可以用来干燥氨气
D.P4O10中所有的原子都满足8电子稳定结构
II.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g) 2NO(g) △H=+180.0kJ·mol-1
2NO(g) △H=+180.0kJ·mol-1
②CO(g)+ O2(g)
O2(g) CO2(g) △H2=-283.0kJ·mol-1
CO2(g) △H2=-283.0kJ·mol-1
③2CO(g)+2NO(g) N2(g)+2CO2(g) △H3
N2(g)+2CO2(g) △H3
请回答下列问题:(1)△H3=___ kJ·mol-1;
(2)下列能说明反应①已达平衡状态的是___ 。
A.单位时间内生成1molNO的同时消耗了0.5molN2
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.在恒温恒容的容器中,混合气体的密度保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
(3)CO和NO2也可发生类似于反应③的变化,方程式为4CO(g)+2NO2(g) N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:
N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:

①5~10min,用CO2的浓度变化表示的反应速率为___ 。
②20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡___ (填“增大”、“减小”或“不变”)。
③该温度下反应的化学平衡常数K=___ L·mol-1(保留两位有效数字)。
I.已知白磷(P4)及其燃烧产物P4O10的结构如图所示。

下列说法正确的是
A.白磷通常保存在水中
B.白磷分子中的键角为109°28'
C.P4O10常用作干燥剂,它可以用来干燥氨气
D.P4O10中所有的原子都满足8电子稳定结构
II.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)
 2NO(g) △H=+180.0kJ·mol-1
2NO(g) △H=+180.0kJ·mol-1②CO(g)+
 O2(g)
O2(g) CO2(g) △H2=-283.0kJ·mol-1
CO2(g) △H2=-283.0kJ·mol-1③2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H3
N2(g)+2CO2(g) △H3请回答下列问题:(1)△H3=
(2)下列能说明反应①已达平衡状态的是
A.单位时间内生成1molNO的同时消耗了0.5molN2
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.在恒温恒容的容器中,混合气体的密度保持不变
D.在恒温恒压的容器中,NO的体积分数保持不变
(3)CO和NO2也可发生类似于反应③的变化,方程式为4CO(g)+2NO2(g)
 N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:
N2(g)+4CO2(g)△H<0。一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,测得相关数据如表:
①5~10min,用CO2的浓度变化表示的反应速率为
②20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡
③该温度下反应的化学平衡常数K=
您最近一年使用:0次
名校
解题方法
4 . 工业上合成氨是在一定条件下进行反应:N2(g)+3H2(g) 2NH3(g),△H=-92.44kJ/mol;其部分工艺流程如图:
2NH3(g),△H=-92.44kJ/mol;其部分工艺流程如图:

请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=__ 。随着温度的升高,K值__ (填“增大”“减小”或“不变”)。
(2)已知三种气体的熔沸点如表所示:
流程图中,处理混合气的具体操作是__ ,继续循环的气体是__ 。
(3)有甲和乙两密闭容器如图所示,甲容器有一个可移动的活塞能使容器内保持恒压,乙容器保持恒容,起始时向这两只容器中分别充入等量的N2与H2的混合气体,并使两容积相等,在催化剂存在的条件下,一定温度下发生反应N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。

①甲、乙达到平衡所需的时间t甲__ t乙(填“>”“<”或“=”)。
②达到平衡后,向甲容器中通入少量氩气,甲容器氮气的转化率__ (填“增大”“减小”或“不变”)。
③达到平衡后,若向两容器中通入等量的原反应气体,达到新平衡时甲容器中NH3的体积分数甲容器__ 乙容器(填“>”“<”或“=”)。
 2NH3(g),△H=-92.44kJ/mol;其部分工艺流程如图:
2NH3(g),△H=-92.44kJ/mol;其部分工艺流程如图:
请回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=
(2)已知三种气体的熔沸点如表所示:
| 气体 | 氮气 | 氢气 | 氨气 |
| 熔点/°C | -210.01 | -252.77 | -77.74 |
| 沸点/°C | -195.79 | -259.23 | -33.42 |
流程图中,处理混合气的具体操作是
(3)有甲和乙两密闭容器如图所示,甲容器有一个可移动的活塞能使容器内保持恒压,乙容器保持恒容,起始时向这两只容器中分别充入等量的N2与H2的混合气体,并使两容积相等,在催化剂存在的条件下,一定温度下发生反应N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。
①甲、乙达到平衡所需的时间t甲
②达到平衡后,向甲容器中通入少量氩气,甲容器氮气的转化率
③达到平衡后,若向两容器中通入等量的原反应气体,达到新平衡时甲容器中NH3的体积分数甲容器
您最近一年使用:0次
名校
解题方法
5 . 运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3、FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
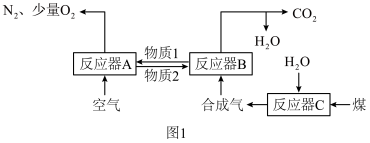
以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:_____
(2)空气经反应器A后得到的尾气_____ (填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____ 。
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。
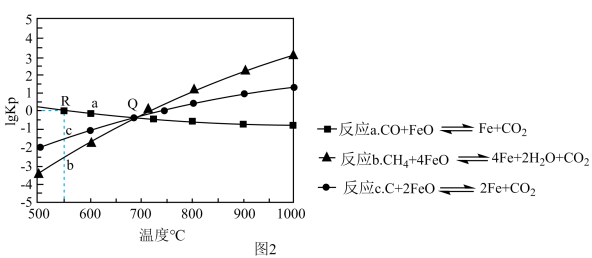
(3)图2涉及的反应中,属于吸热反应的是反应_____ (填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为_____ 。
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=_____ 。
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向_____ (填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率_____ (填“增大”“减小”或“不变”)。

以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图1所示。
①C(s)+H2O(g)═CO(g)+H2(g)△H1=akJ•mol﹣1
②CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)△H2=bkJ•mol﹣1
(1)写出图1中总反应的热化学方程式:
(2)空气经反应器A后得到的尾气
Ⅱ.用FeO作载氧剂,部分反应的lgKp[K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图2所示。

(3)图2涉及的反应中,属于吸热反应的是反应
(4)R点对应温度下,向某恒容密闭容器中通入1mol CO,并加入足量的FeO,只发生反应CO(g)+FeO(s)⇌Fe(s)+CO2(g),则CO的平衡转化率为
Ⅲ.在T℃下,向某恒容密闭容器中加入1mol CH4(g)和4mol FeO(s)进行反应:CH4(g)+4FeO(s)⇌4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为p0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp=
(6)若起始时向该容器中加入1mol CH4(g),4mol FeO(s),1mol H2O(g),0.5mol CO2(g),此时反应向
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4(g)的平衡转化率
您最近一年使用:0次
2020-07-23更新
|
292次组卷
|
5卷引用:湖南2020年2月高三线上联考(全国I卷)理综化学试题
名校
解题方法
6 . 三氧化钼( )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:
⑴已知:①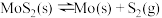

②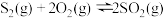

③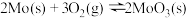

则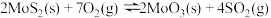 的
的
________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
⑵若在恒温恒容条件下,仅发生反应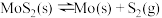 。
。
①下列说法正确的是________ (填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
的量,平衡正向移动
②达到平衡时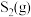 的浓度为1.4 mol·L−1,充入一定量的
的浓度为1.4 mol·L−1,充入一定量的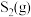 ,反应再次达到平衡,
,反应再次达到平衡,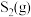 浓度
浓度________ (填“ ”“
”“ ”或“
”或“ ”) 1.4 mol·L−1。
”) 1.4 mol·L−1。
⑶在 恒容密闭容器中充入
恒容密闭容器中充入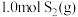 和
和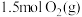 ,若仅发生反应:
,若仅发生反应: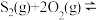
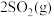 ,
,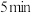 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则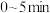 内,
内,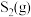 的反应速率为
的反应速率为________  。
。
⑷在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应: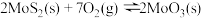

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
①
________ (填“ ”“
”“ ”或“
”或“ ”)0;比较
”)0;比较 、
、 、
、 的大小:
的大小:________ 。
②若初始时通入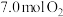 ,
, 为
为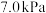 ,则
,则 点平衡常数
点平衡常数
________ (用气体平衡分压代替气体平衡浓度计算,分压 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
 )是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为
)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分为 )通过一定条件来制备。回答下列相关问题:
)通过一定条件来制备。回答下列相关问题:⑴已知:①
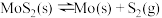

②
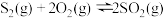

③
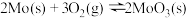

则
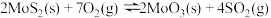 的
的
 、
、 、
、 的代数式表示)。
的代数式表示)。⑵若在恒温恒容条件下,仅发生反应
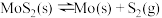 。
。①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加
 的量,平衡正向移动
的量,平衡正向移动②达到平衡时
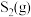 的浓度为1.4 mol·L−1,充入一定量的
的浓度为1.4 mol·L−1,充入一定量的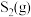 ,反应再次达到平衡,
,反应再次达到平衡,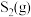 浓度
浓度 ”“
”“ ”或“
”或“ ”) 1.4 mol·L−1。
”) 1.4 mol·L−1。⑶在
 恒容密闭容器中充入
恒容密闭容器中充入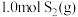 和
和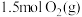 ,若仅发生反应:
,若仅发生反应: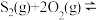
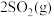 ,
,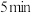 后反应达到平衡,此时容器压强为起始时的80%,则
后反应达到平衡,此时容器压强为起始时的80%,则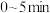 内,
内,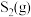 的反应速率为
的反应速率为 。
。⑷在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: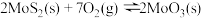

 。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
①

 ”“
”“ ”或“
”或“ ”)0;比较
”)0;比较 、
、 、
、 的大小:
的大小:②若初始时通入
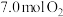 ,
, 为
为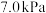 ,则
,则 点平衡常数
点平衡常数
 总压
总压 气体的物质的量分数,写出计算式即可)。
气体的物质的量分数,写出计算式即可)。
您最近一年使用:0次
2020-06-11更新
|
353次组卷
|
5卷引用:云南省楚雄彝族自治州2020届高三上学期期末考试理综化学试题
云南省楚雄彝族自治州2020届高三上学期期末考试理综化学试题陕西省2020届高三3月线上联考理综化学试题吉林省白山市2020届高三二模理综化学试卷湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)2021年秋季高三化学开学摸底考试卷01(山东专用)
7 . 开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
(1)催化反应室中的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算ΔH=_______ 。反应来自煤的气化。已知该反应的平衡常数表达式为K=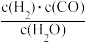 ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________ 。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________ 。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正___ v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___ 。
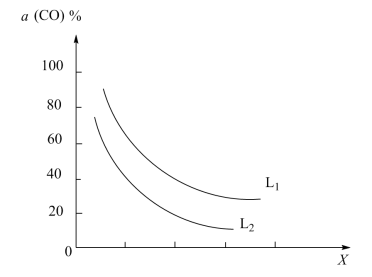
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___ (填“温度”或“压强”),且L1___ L2(填“>”“<”或“=”)。
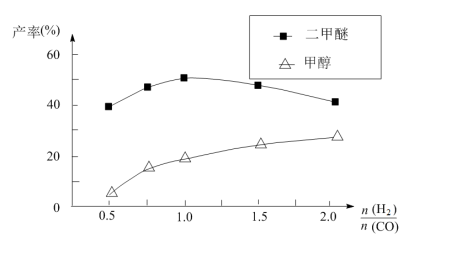
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____ 。
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
(1)催化反应室中的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算ΔH=
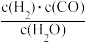 ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L−1) | 0.46 | 1.0 | 1.0 |
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表

(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比
 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
您最近一年使用:0次
解题方法
8 . (1)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___ kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
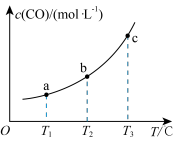
①该反应△H__________ 0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_______ K2(填“>”、“<”或“=”)。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=____________ 。
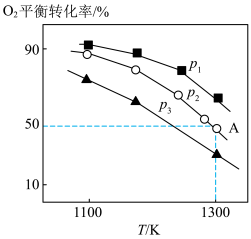
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。
测得氧气的平衡转化率与起始压强、温度的关系如图所示:
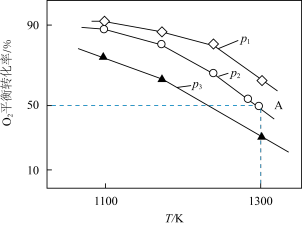
①p1、p2、p3的大小:_________ 。
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=________ (用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
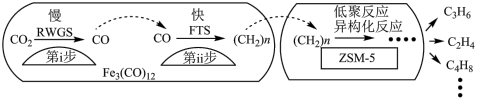
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____ ;
②下列说法正确的是______ ;
a 第ⅰ步所反应为:CO2+H2 CO+H2O
CO+H2O
b 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)
 CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
①该反应△H
②若T1、T2时的平衡常数分别为K1、K2,则K1
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g)
 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:

①p1、p2、p3的大小:
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
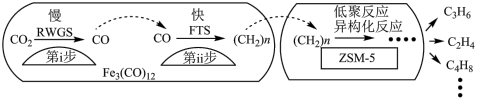
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加
②下列说法正确的是
a 第ⅰ步所反应为:CO2+H2
 CO+H2O
CO+H2Ob 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
您最近一年使用:0次
名校
9 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___ 。利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___ L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=___ kJ·mol-1。
(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ (填字母)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将___ (填“增大”“减小”或“不变”)
(4)已知N2O4(g) 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___ 。
A.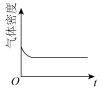 B.
B.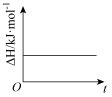 C.
C. D.
D.
(1)NO2可用水吸收,相应的化学反应方程式为
 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是(2)已知:2SO2(g)+O2(g)
 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-12NO(g)+O2(g)
 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将
(4)已知N2O4(g)
 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2019-10-28更新
|
93次组卷
|
2卷引用:安徽省霍邱县第二中学2019-2020学年高二上学期第一次月考化学试题
名校
解题方法
10 . 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)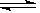 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)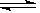 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)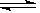 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=_______ kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______ 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_________ 。(保留2位小数)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)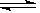 CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH_____ 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___________________________________ 。
(1)已知:2SO2(g)+O2(g)
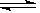 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-12NO(g)+O2(g)
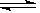 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1则反应NO2(g)+SO2(g)
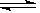 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
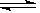 CH3OH(g)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH
您最近一年使用:0次



