名校
解题方法
1 . (Ⅰ) 时,在容积为
时,在容积为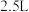 的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质
的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质 (其中
(其中 均为气体,
均为气体, 为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
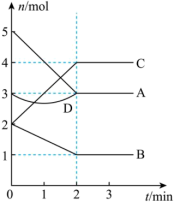
(1) 内,用
内,用 表示该反应的平均反应速率
表示该反应的平均反应速率
_____ 。
(2)该反应化学方程式为_____ 。
(3) 时,该反应的化学平衡常数为
时,该反应的化学平衡常数为_____ (保留三位有效数字)。
(4)第 时,保持其它条件不变,仅将容器体积变为
时,保持其它条件不变,仅将容器体积变为 并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)
并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)
(Ⅱ)
(5) 时,
时,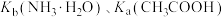 均约为
均约为 。则
。则 时,
时, 溶液pH约为
溶液pH约为_____ ,该溶液中水电离出的 浓度约为
浓度约为_____ ; 时,
时, 溶液的pH约为
溶液的pH约为_____ ,该溶液中水电离出的 浓度约为
浓度约为_____ 。
 时,在容积为
时,在容积为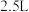 的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质
的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质 (其中
(其中 均为气体,
均为气体, 为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
(1)
 内,用
内,用 表示该反应的平均反应速率
表示该反应的平均反应速率
(2)该反应化学方程式为
(3)
 时,该反应的化学平衡常数为
时,该反应的化学平衡常数为(4)第
 时,保持其它条件不变,仅将容器体积变为
时,保持其它条件不变,仅将容器体积变为 并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)
并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)A.新平衡时,A的物质的量浓度大于 |
B.新平衡时,B的物质的量浓度小于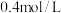 |
C.新平衡时,B的物质的量浓度大于 |
| D.新平衡时,该反应的正反应速率一定比原平衡小 |
(Ⅱ)
(5)
 时,
时,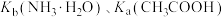 均约为
均约为 。则
。则 时,
时, 溶液pH约为
溶液pH约为 浓度约为
浓度约为 时,
时, 溶液的pH约为
溶液的pH约为 浓度约为
浓度约为
您最近半年使用:0次
名校
解题方法
2 . 氨气是重要的化工原料,在国民经济中占重要地位。工业合成氨的反应为
 。
。
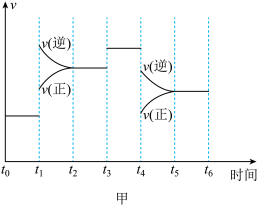
(1)图甲表示合成氨反应在某段时间 中反应速率与时间的曲线图,
中反应速率与时间的曲线图, 、
、 、
、 时刻分别改变某一外界条件,则在下列达到化学平衡的时间段中,
时刻分别改变某一外界条件,则在下列达到化学平衡的时间段中, 的体积分数最小的一段时间是
的体积分数最小的一段时间是___________ (填字母)。 时刻改变的条件是
时刻改变的条件是___________ 。
A. B.
B. C.
C. D.
D.
(2)在773 K时,分别将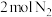 和
和 充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中
充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中 、
、 与反应时间t的关系如表所示:
与反应时间t的关系如表所示:
①该温度下,此反应的平衡常数
___________ 。
②该温度下,若向同容积的另一容器中投入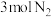 和
和 ,则达到平衡时
,则达到平衡时 的转化率将
的转化率将___________ (填“变大”、“变小”或“不变”)。
③该温度下,若向同容积的另一容器中投入的 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 ,则此时
,则此时
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
④由表中的实验数据计算得到“浓度—时间”的关系可用图乙中的曲线表示,表示 的曲线是
的曲线是___________ 。在此温度下,若起始充入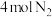 和
和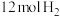 ,则反应刚达到平衡时,表示
,则反应刚达到平衡时,表示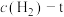 的曲线上相应的点为
的曲线上相应的点为___________ 。


 。
。(1)图甲表示合成氨反应在某段时间
 中反应速率与时间的曲线图,
中反应速率与时间的曲线图, 、
、 、
、 时刻分别改变某一外界条件,则在下列达到化学平衡的时间段中,
时刻分别改变某一外界条件,则在下列达到化学平衡的时间段中, 的体积分数最小的一段时间是
的体积分数最小的一段时间是 时刻改变的条件是
时刻改变的条件是
A.
 B.
B. C.
C.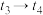 D.
D.
(2)在773 K时,分别将
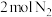 和
和 充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中
充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中 、
、 与反应时间t的关系如表所示:
与反应时间t的关系如表所示:| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
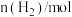 | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
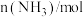 | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |

②该温度下,若向同容积的另一容器中投入
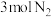 和
和 ,则达到平衡时
,则达到平衡时 的转化率将
的转化率将③该温度下,若向同容积的另一容器中投入的
 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 ,则此时
,则此时
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。④由表中的实验数据计算得到“浓度—时间”的关系可用图乙中的曲线表示,表示
 的曲线是
的曲线是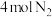 和
和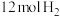 ,则反应刚达到平衡时,表示
,则反应刚达到平衡时,表示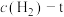 的曲线上相应的点为
的曲线上相应的点为
您最近半年使用:0次
名校
3 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
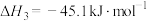
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

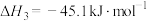
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。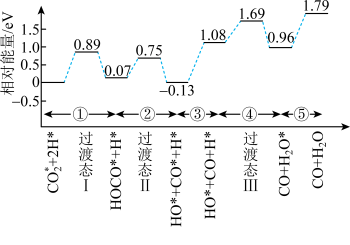

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。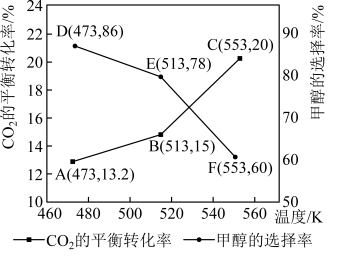
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近半年使用:0次
2023-09-30更新
|
254次组卷
|
5卷引用:湖南省平江县颐华高级中学2023-2024学年高三下学期入学考试化学试题
4 .  可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
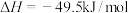
反应2:
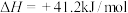 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________  。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。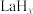 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
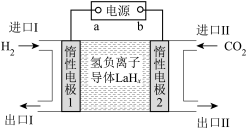
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (
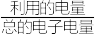 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

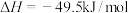
反应2:

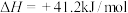 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、 、
、 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是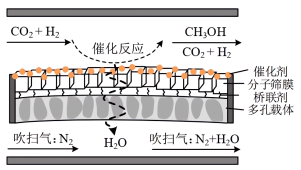
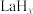 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为
 ×100%)。
×100%)。
您最近半年使用:0次
2023-06-03更新
|
674次组卷
|
5卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题
湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题重庆市巴蜀中学校2023学年高三模拟预测化学试题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)广西名校2023-2024学年高三上学期仿真卷(一)化学试题
名校
5 . 运用化学反应原理研究合成氨反应有重要意义。请回答下列问题,
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下___________ (“能”或“不能”)自发进行。
(2)已知在T℃时,反应N2(g)+3H2(g) 2NH3(g)的平衡常数K=0.5,相关化学键键能数据如表:
2NH3(g)的平衡常数K=0.5,相关化学键键能数据如表:
①T℃时,2NH3(g) N2(g)+3H2(g)的ΔH=
N2(g)+3H2(g)的ΔH=___________ 。
②T℃时,在1L密闭容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4mol、2mol、4mol,则此时反应v正(N2)___________ v逆(N2)(填“>”“<”“=”或“不能确定”)。
(3)已知合成氨反应的速率方程为:v=kcα(N2)cβ(H2)c-1(NH3),k为反应速率常数。在合成氨过程中,需要不断分离出氨,该操作的目的是___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(g)。
CO(NH2)2(1)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填字母)。
A.增大CO2的浓度 B.增大压强
C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH=-117kJ/mol
NH2COONH4(1) ΔH=-117kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH=+15kJ/mol,
CO(NH2)2(1)+H2O(g) ΔH=+15kJ/mol,
第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
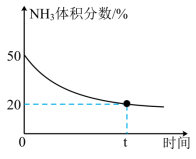
③某实验小组为了模拟工业合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(g),反应过程中NH3的体积分数如图所示。实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数
CO(NH2)2(1)+H2O(g),反应过程中NH3的体积分数如图所示。实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数___________ (MPa)-2(已知:分压=总压×体积分数)。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下(2)已知在T℃时,反应N2(g)+3H2(g)
 2NH3(g)的平衡常数K=0.5,相关化学键键能数据如表:
2NH3(g)的平衡常数K=0.5,相关化学键键能数据如表:| 化学键 | N≡N | H-H | N-H |
| 键能/(kJ·mol-1) | 946 | 436 | 390.8 |
 N2(g)+3H2(g)的ΔH=
N2(g)+3H2(g)的ΔH=②T℃时,在1L密闭容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4mol、2mol、4mol,则此时反应v正(N2)
(3)已知合成氨反应的速率方程为:v=kcα(N2)cβ(H2)c-1(NH3),k为反应速率常数。在合成氨过程中,需要不断分离出氨,该操作的目的是
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(g)。
CO(NH2)2(1)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强
C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH=-117kJ/mol
NH2COONH4(1) ΔH=-117kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH=+15kJ/mol,
CO(NH2)2(1)+H2O(g) ΔH=+15kJ/mol,第一步反应速率快,可判断活化能较大的是
③某实验小组为了模拟工业合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(g),反应过程中NH3的体积分数如图所示。实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数
CO(NH2)2(1)+H2O(g),反应过程中NH3的体积分数如图所示。实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数
您最近半年使用:0次
名校
解题方法
6 . 我国政府承诺二氧化碳排放在2030年前达到峰值,2060年前实现碳中和,彰显作为大国的担当和责任。 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为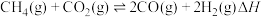 。回答下列问题:
。回答下列问题:
(1)已知:①
②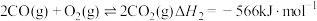
③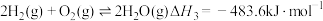
则
___________  。
。
(2)恒容密闭容器中可逆反应 达到平衡状态的标志是___________(填序号)。
达到平衡状态的标志是___________(填序号)。
(3)容器容积为1L,控制 和
和 初始投料量分别为2mol和3mol,发生反应:
初始投料量分别为2mol和3mol,发生反应: ,甲烷的平衡转化率与温度、压强的关系如图甲所示。
,甲烷的平衡转化率与温度、压强的关系如图甲所示。
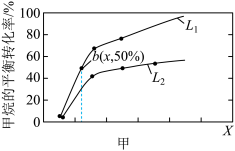
则 代表
代表___________ (填“温度”或“压强”):
___________  (填“大于”或“小于”),并请说出理由:
(填“大于”或“小于”),并请说出理由:___________ ;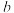 点反应的平衡常数为
点反应的平衡常数为___________ 。
(4)500℃下,将 和
和 的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得
的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
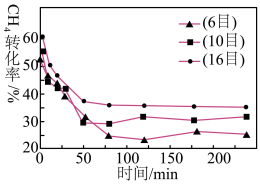
由图乙可知,75min后 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)①温度为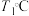 时,
时,
实验测得: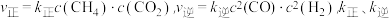 为速率常数。
为速率常数。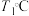 时,
时, =
=___________ (以 表示)。
表示)。
②当温度改变为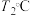 时,
时,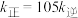 ,则
,则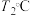 时平衡压强
时平衡压强___________ 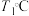 时平衡压强(填“>”“<”或“=”),理由是
时平衡压强(填“>”“<”或“=”),理由是___________ 。
 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为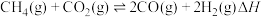 。回答下列问题:
。回答下列问题:(1)已知:①

②
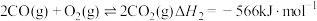
③
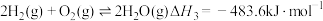
则

 。
。(2)恒容密闭容器中可逆反应
 达到平衡状态的标志是___________(填序号)。
达到平衡状态的标志是___________(填序号)。A.单位时间内生成1mol 的同时消耗2molCO 的同时消耗2molCO |
| B.混合气体的密度不再改变 |
C.反应速率 |
| D.混合气体的平均相对分子质量不再改变 |
 和
和 初始投料量分别为2mol和3mol,发生反应:
初始投料量分别为2mol和3mol,发生反应: ,甲烷的平衡转化率与温度、压强的关系如图甲所示。
,甲烷的平衡转化率与温度、压强的关系如图甲所示。
则
 代表
代表
 (填“大于”或“小于”),并请说出理由:
(填“大于”或“小于”),并请说出理由: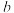 点反应的平衡常数为
点反应的平衡常数为(4)500℃下,将
 和
和 的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得
的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
由图乙可知,75min后
 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为(5)①温度为
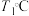 时,
时,
实验测得:
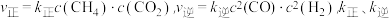 为速率常数。
为速率常数。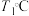 时,
时, =
= 表示)。
表示)。②当温度改变为
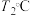 时,
时,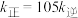 ,则
,则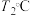 时平衡压强
时平衡压强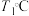 时平衡压强(填“>”“<”或“=”),理由是
时平衡压强(填“>”“<”或“=”),理由是
您最近半年使用:0次
2023-02-07更新
|
350次组卷
|
3卷引用:湖南省醴陵市第一中学2023届高三第六次月考化学试题
名校
解题方法
7 . 随着我国“碳达峰”、“碳中和”目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以 和
和 为原料合成尿素:
为原料合成尿素:
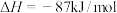 。
。
(1)有利于提高 平衡转化率的措施是_______(填标号)。
平衡转化率的措施是_______(填标号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如图甲所示。
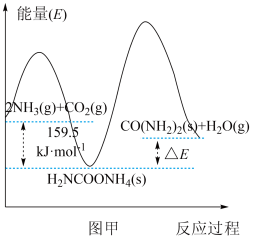
第一步: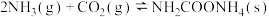

第二步: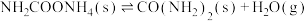

反应速率较快的是反应_______ (填“第一步”或“第二步”)。
Ⅱ.以和催化重整制备合成气: 。
。
(3)在密闭容器中通入物质的量均为0.2mol的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应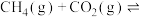
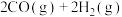 ,
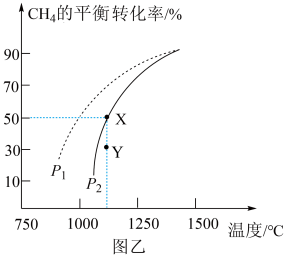
, 的平衡转化率随温度、压强的变化关系如图乙所示:
的平衡转化率随温度、压强的变化关系如图乙所示:
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填标号)。
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率: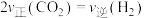 D.同时断裂2mol C—H和1mol H—H
D.同时断裂2mol C—H和1mol H—H
②由图乙可知,压强
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
_______ (用含 的代数式表示)。
的代数式表示)。
Ⅲ.电化学法还原二氧化碳制乙烯。
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应为_______ ;该装置中使用的是_______ (填“阳”或“阴”)离子交换膜。
Ⅰ.以
 和
和 为原料合成尿素:
为原料合成尿素:
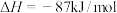 。
。(1)有利于提高
 平衡转化率的措施是_______(填标号)。
平衡转化率的措施是_______(填标号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |

第一步:
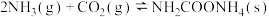

第二步:
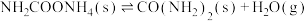

反应速率较快的是反应
Ⅱ.以和催化重整制备合成气:
 。
。(3)在密闭容器中通入物质的量均为0.2mol的
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应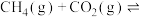
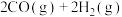 ,
, 的平衡转化率随温度、压强的变化关系如图乙所示:
的平衡转化率随温度、压强的变化关系如图乙所示:
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率:
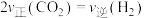 D.同时断裂2mol C—H和1mol H—H
D.同时断裂2mol C—H和1mol H—H②由图乙可知,压强

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则X点对应温度下的
,则X点对应温度下的
 的代数式表示)。
的代数式表示)。Ⅲ.电化学法还原二氧化碳制乙烯。
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图丙所示:

(4)阴极电极反应为
您最近半年使用:0次
2023-02-06更新
|
340次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三下学期月考卷(六)化学试题
名校
解题方法
8 . 根据化学反应原理回答下列问题:
(1)在一定条件下的密闭容器中,等物质的量的A、B发生可逆反应 。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡
。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡_______ 移动(填“正向”、“逆向”或“不”);再达到平衡时,B的百分含量_______ (填“增大”、“减小”或“不变”)。
(2)在一定条件下的密闭容器中,可逆反应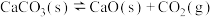 △H>0,达到平衡。如果保持温度和容器容积不变,再通入少量
△H>0,达到平衡。如果保持温度和容器容积不变,再通入少量 ,则平衡
,则平衡_______ 移动(填“正向”、“逆向”或“不”);再达到平衡时,容器的压强_______ (填“增大”、“减小”或“不变”)
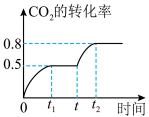
(3)已知 ,在一定温度下,向一恒温容积可变的容器中充入1mol
,在一定温度下,向一恒温容积可变的容器中充入1mol  (g)、2mol
(g)、2mol  (g),
(g), 的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若
的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若 时容器容积为1000mL,则
时容器容积为1000mL,则 时容器容积为
时容器容积为_______ mL。
(4)一定量的 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: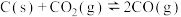 ,平衡时,体系中气体体积分数与温度的关系如图所示:
,平衡时,体系中气体体积分数与温度的关系如图所示:

已知:气体分压(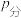 )=气体总压(
)=气体总压( )×体积分数。925℃时,已知总压为
)×体积分数。925℃时,已知总压为 ,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______ 。
(5) 和
和 组合形成的燃料电池的结构如图所示,质子(
组合形成的燃料电池的结构如图所示,质子( )交换膜左右两侧的溶液均为1L 2
)交换膜左右两侧的溶液均为1L 2 的
的 溶液。
溶液。
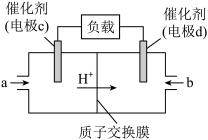
电极c是_______ (填“正”或“负”)极,写出物质a在电极c上发生的反应式为_______ 。
(1)在一定条件下的密闭容器中,等物质的量的A、B发生可逆反应
 。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡
。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡(2)在一定条件下的密闭容器中,可逆反应
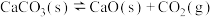 △H>0,达到平衡。如果保持温度和容器容积不变,再通入少量
△H>0,达到平衡。如果保持温度和容器容积不变,再通入少量 ,则平衡
,则平衡(3)已知
 ,在一定温度下,向一恒温容积可变的容器中充入1mol
,在一定温度下,向一恒温容积可变的容器中充入1mol  (g)、2mol
(g)、2mol  (g),
(g), 的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若
的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若 时容器容积为1000mL,则
时容器容积为1000mL,则 时容器容积为
时容器容积为
(4)一定量的
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: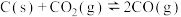 ,平衡时,体系中气体体积分数与温度的关系如图所示:
,平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(
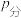 )=气体总压(
)=气体总压( )×体积分数。925℃时,已知总压为
)×体积分数。925℃时,已知总压为 ,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(5)
 和
和 组合形成的燃料电池的结构如图所示,质子(
组合形成的燃料电池的结构如图所示,质子( )交换膜左右两侧的溶液均为1L 2
)交换膜左右两侧的溶液均为1L 2 的
的 溶液。
溶液。
电极c是
您最近半年使用:0次
2022-11-06更新
|
555次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期中考试化学试题
9 . 平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。回答下列各小题。
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
(1)相同浓度的ClO-、 、
、 、
、 结合H+的能力最强的为
结合H+的能力最强的为_______ 。(填离子符号)
II.水在25℃和95℃时电离平衡曲线如图。
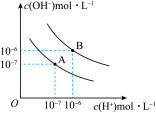
(2)已知在25℃时,将pH=12的NaOH溶液与pH=2的H2SO4溶液均升温至35℃,两溶液pH变化分别为_______(填字母)。
(3)在曲线B所对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=6,则NaOH溶液与H2SO4溶液的体积比为_______ 。
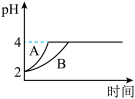
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量Zn粒,反应过程中两溶液pH变化如图。图中表示醋酸溶液中pH变化曲线_______ (填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1_______ m2。 (选填“<”、“=”、“>”)
(5)25 C时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图所示。
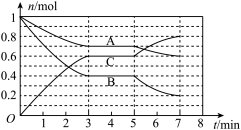
根据图1数据。写出该反应的化学方程式:_______ ;在5~7min内,若K值不变,则此处曲线变化的原因是_______ 。
I.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO Ka=4.7×10-8
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7
(1)相同浓度的ClO-、
 、
、 、
、 结合H+的能力最强的为
结合H+的能力最强的为II.水在25℃和95℃时电离平衡曲线如图。

(2)已知在25℃时,将pH=12的NaOH溶液与pH=2的H2SO4溶液均升温至35℃,两溶液pH变化分别为_______(填字母)。
| A.增加、减小 | B.增加、增加 | C.减小、不变 | D.不变、减小 |
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量Zn粒,反应过程中两溶液pH变化如图。图中表示醋酸溶液中pH变化曲线

(5)25 C时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图所示。

根据图1数据。写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
10 . 研究含氮、硫物质之间的转化,对资源的综合利用具有重要意义。
(1)硫酸生产中, 催化氧化生成
催化氧化生成 :
: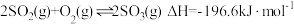
①在恒容密闭容器中达到平衡后,能使平衡正向移动并提高 转化率的是
转化率的是_______
A.向容器中通入 B.向容器中通入
B.向容器中通入 C.使用催化剂 D.降低温度
C.使用催化剂 D.降低温度
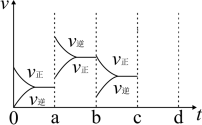
②如图表示 催化氧化生成
催化氧化生成 在密闭容器中达到平衡时,由于条件改变而引起反应速率的变化情况,a时刻改变的条件可能是
在密闭容器中达到平衡时,由于条件改变而引起反应速率的变化情况,a时刻改变的条件可能是____ ;若c时刻增大压强,把反应速率变化情况画在c~d处____ 。
(2)合成氨反应 是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率
是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率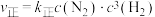 ,逆反应速率
,逆反应速率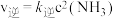 。
。 、
、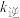 为速率常数。平衡常数K与温度的关系如图。
为速率常数。平衡常数K与温度的关系如图。
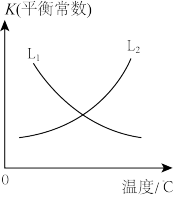
①表示正反应的平衡常数K与温度变化的曲线为_______ (填 或
或 )
)
②平衡时,合成氨反应的平衡常数
_______ (用 ,
,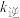 表示)
表示)
(3)将一定量 气体充入恒容的密闭容器中,控制反应温度为T1,发生的反应为:
气体充入恒容的密闭容器中,控制反应温度为T1,发生的反应为: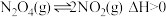 。
。
①下列可作为反应达到平衡的判据是_______
A.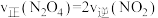 B.气体的压强不变 C.
B.气体的压强不变 C. 不变 D.容器内颜色不变
不变 D.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为P, 的平衡转化率为
的平衡转化率为 ,则反应
,则反应 的平衡常数
的平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
(1)硫酸生产中,
 催化氧化生成
催化氧化生成 :
: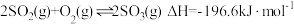
①在恒容密闭容器中达到平衡后,能使平衡正向移动并提高
 转化率的是
转化率的是A.向容器中通入
 B.向容器中通入
B.向容器中通入 C.使用催化剂 D.降低温度
C.使用催化剂 D.降低温度②如图表示
 催化氧化生成
催化氧化生成 在密闭容器中达到平衡时,由于条件改变而引起反应速率的变化情况,a时刻改变的条件可能是
在密闭容器中达到平衡时,由于条件改变而引起反应速率的变化情况,a时刻改变的条件可能是
(2)合成氨反应
 是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率
是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率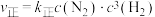 ,逆反应速率
,逆反应速率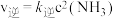 。
。 、
、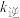 为速率常数。平衡常数K与温度的关系如图。
为速率常数。平衡常数K与温度的关系如图。
①表示正反应的平衡常数K与温度变化的曲线为
 或
或 )
)②平衡时,合成氨反应的平衡常数

 ,
,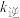 表示)
表示)(3)将一定量
 气体充入恒容的密闭容器中,控制反应温度为T1,发生的反应为:
气体充入恒容的密闭容器中,控制反应温度为T1,发生的反应为: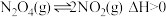 。
。①下列可作为反应达到平衡的判据是
A.
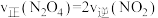 B.气体的压强不变 C.
B.气体的压强不变 C. 不变 D.容器内颜色不变
不变 D.容器内颜色不变②t1时刻反应达到平衡,混合气体平衡总压强为P,
 的平衡转化率为
的平衡转化率为 ,则反应
,则反应 的平衡常数
的平衡常数
您最近半年使用:0次
2022-09-02更新
|
377次组卷
|
3卷引用: 湖南省株洲市第八中学2022-2023学年高三上学期第三次月考化学试题



