(Ⅰ) 时,在容积为
时,在容积为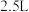 的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质
的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质 (其中
(其中 均为气体,
均为气体, 为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
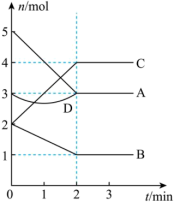
(1) 内,用
内,用 表示该反应的平均反应速率
表示该反应的平均反应速率
_____ 。
(2)该反应化学方程式为_____ 。
(3) 时,该反应的化学平衡常数为
时,该反应的化学平衡常数为_____ (保留三位有效数字)。
(4)第 时,保持其它条件不变,仅将容器体积变为
时,保持其它条件不变,仅将容器体积变为 并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)
并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)
(Ⅱ)
(5) 时,
时,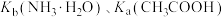 均约为
均约为 。则
。则 时,
时, 溶液pH约为
溶液pH约为_____ ,该溶液中水电离出的 浓度约为
浓度约为_____ ; 时,
时, 溶液的pH约为
溶液的pH约为_____ ,该溶液中水电离出的 浓度约为
浓度约为_____ 。
 时,在容积为
时,在容积为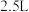 的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质
的恒容密闭容器中,与同一个化学反应有关的仅有的四种物质 (其中
(其中 均为气体,
均为气体, 为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
为固体)的物质的量随反应时间的变化如图所示。回答下列问题:
(1)
 内,用
内,用 表示该反应的平均反应速率
表示该反应的平均反应速率
(2)该反应化学方程式为
(3)
 时,该反应的化学平衡常数为
时,该反应的化学平衡常数为(4)第
 时,保持其它条件不变,仅将容器体积变为
时,保持其它条件不变,仅将容器体积变为 并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)
并保持不变,使反应达到新的化学平衡状态,下列说法正确的是_____(填写字母)A.新平衡时,A的物质的量浓度大于 |
B.新平衡时,B的物质的量浓度小于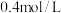 |
C.新平衡时,B的物质的量浓度大于 |
| D.新平衡时,该反应的正反应速率一定比原平衡小 |
(Ⅱ)
(5)
 时,
时,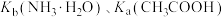 均约为
均约为 。则
。则 时,
时, 溶液pH约为
溶液pH约为 浓度约为
浓度约为 时,
时, 溶液的pH约为
溶液的pH约为 浓度约为
浓度约为
更新时间:2024-02-16 10:05:50
|
相似题推荐
【推荐1】氨是一种重要的化工原料,工业上利用氮气和氢气催化合成氨是人工固氮的主要手段,对人类生存、社会进步和经济发展都有着重大意义。请回答下列问题:
(1)合成氨的反应历程和能量变化如图所示:
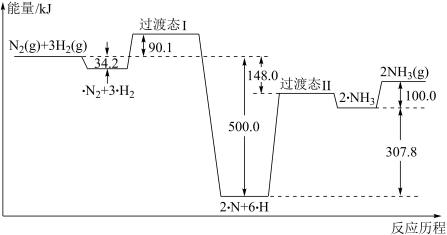
①合成氨反应的热化学方程式为_______ 。
②对总反应速率影响较大的步骤的能垒(活化能)为_______ kJ,该步骤的化学方程式为_______ 。
(2)按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
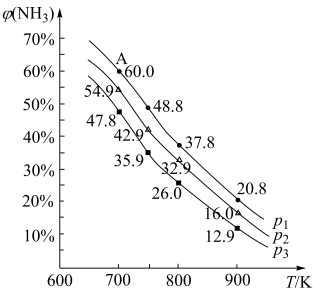
①判断压强从小到大的顺序为_______ ,理由是_______ 。
②A点(700K,0.5MPa)的压强平衡常数Kp=_______ ,此时的平衡转化率α(N2)=_______ 。
(3)常温常压下,以N2和H2O为原料的电化学合成氨是极具应用前途的绿色合成氨过程。在阳极室、阴极室中加入Na2SO4电解液,以镍的有机配位化合物与炭黑合成的物质以及铂为电极,实验室模拟氨的电化学合成过程如图所示。
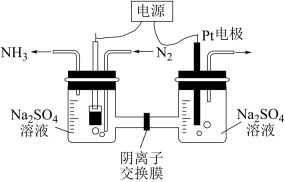
①阳极的电极反应式为_______ 。
②电路上转移1.5mol电子时,阴极收集到的气体体积小于11.2L(标准状况),可能的原因为_______ 。
(1)合成氨的反应历程和能量变化如图所示:

①合成氨反应的热化学方程式为
②对总反应速率影响较大的步骤的能垒(活化能)为
(2)按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。

①判断压强从小到大的顺序为
②A点(700K,0.5MPa)的压强平衡常数Kp=
(3)常温常压下,以N2和H2O为原料的电化学合成氨是极具应用前途的绿色合成氨过程。在阳极室、阴极室中加入Na2SO4电解液,以镍的有机配位化合物与炭黑合成的物质以及铂为电极,实验室模拟氨的电化学合成过程如图所示。

①阳极的电极反应式为
②电路上转移1.5mol电子时,阴极收集到的气体体积小于11.2L(标准状况),可能的原因为
您最近半年使用:0次
【推荐2】丙烯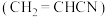 是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈
是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈 、氢氰酸、丙烯醛
、氢氰酸、丙烯醛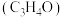 等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈
等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈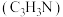 的主要反应如下:
的主要反应如下:
Ⅰ.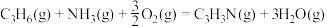
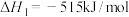
Ⅱ.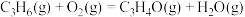
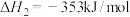
回答下列问题:
(1)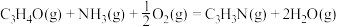

_______  。
。
(2)反应Ⅰ在_______ (填“高温”“低温”或“任意”)条件下可自发进行:恒温,体系达到平衡后,若压缩容器体积,则反应Ⅱ的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(3)工业生产条件下的丙烯氨氧化过程十分复杂。下列说法正确的是_______。
(4)已知对于反应: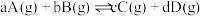 ,其标准平衡常数:
,其标准平衡常数: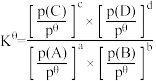 。T℃,压强为
。T℃,压强为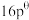 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol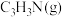 ,b mol
,b mol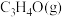 ,此时
,此时 的分压
的分压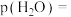
_______ (分压=总压×物质的量分数,用含a,b的代数式表示,下同);反应Ⅱ的标准平衡常数为_______ 。
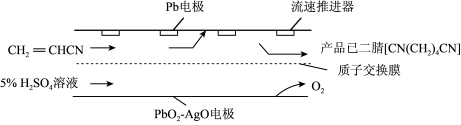
(5)以丙烯腈为原料,利用电解原理合成已二腈 可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为
可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为_______ 。
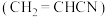 是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈
是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,副产物有乙腈 、氢氰酸、丙烯醛
、氢氰酸、丙烯醛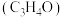 等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈
等,以丙烯、氨气和氧气为原料,在催化剂存在下合成丙烯腈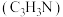 的主要反应如下:
的主要反应如下:Ⅰ.
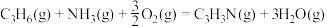
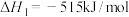
Ⅱ.
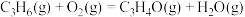
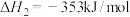
回答下列问题:
(1)
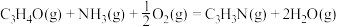

 。
。(2)反应Ⅰ在
(3)工业生产条件下的丙烯氨氧化过程十分复杂。下列说法正确的是_______。
| A.原料丙烯可以从石油裂解气中分离得到 |
| B.为提高丙烯的平衡转化率和丙烯腈的选择性,需要研究高性能催化剂 |
| C.加入水蒸气可防止原料混合气中丙烯与空气的比例处于爆炸范围内产生危险 |
| D.生产过程中会产生大量的含氰废水,对环境的危害很大,排放前必须除去 |
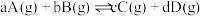 ,其标准平衡常数:
,其标准平衡常数: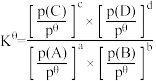 。T℃,压强为
。T℃,压强为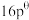 的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol
的恒压密闭容器中,通入1mol丙烯、1mol氨气和3mol氧气发生反应Ⅰ、Ⅱ,达到平衡时,容器内有amol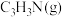 ,b mol
,b mol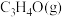 ,此时
,此时 的分压
的分压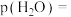
(5)以丙烯腈为原料,利用电解原理合成已二腈
 可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为
可减少氮氧化物的排放,其装置如图所示,电解时Pb电极发生的电极反应式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
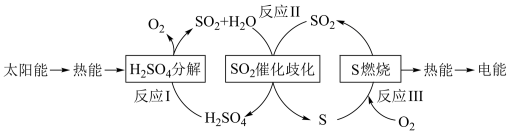
【推荐3】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________________________________ 。
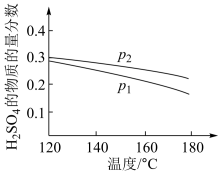
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______ p 1(填“>”或“<”),得出该结论的理由是________________ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+_________ ===_________ +_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+===S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO和 可作为能源和化工原料,应用十分广泛。工业上可利用CO或
可作为能源和化工原料,应用十分广泛。工业上可利用CO或 与
与 反应来制备甲醇。
反应来制备甲醇。
反应①: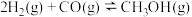 ,
,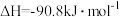
反应②: ,
,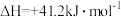
(1)写出用 与
与 反应制备甲醇的热化学方程式
反应制备甲醇的热化学方程式________________ 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应: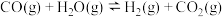 ,该反应平衡常数随温度的变化如下表所示:
,该反应平衡常数随温度的变化如下表所示:
回答下列问题:
①该反应的化学平衡常数表达式为
________________ 。
②升高温度,该平衡的移动方向是________________ (填“正向”或“逆向”)。
(3)某温度下,平衡浓度符合下式: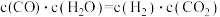 ,试判断此时的温度为
,试判断此时的温度为____ 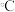 。
。
(4)一定条件下,可以由 和
和 合成
合成 ,同时还生成
,同时还生成 。向恒容密闭容器中充入一定量的
。向恒容密闭容器中充入一定量的 和
和 ,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
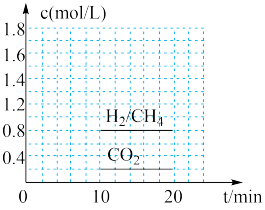
该温度下的的平衡常数等于________________ 。
 可作为能源和化工原料,应用十分广泛。工业上可利用CO或
可作为能源和化工原料,应用十分广泛。工业上可利用CO或 与
与 反应来制备甲醇。
反应来制备甲醇。反应①:
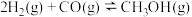 ,
,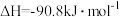
反应②:
 ,
,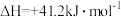
(1)写出用
 与
与 反应制备甲醇的热化学方程式
反应制备甲醇的热化学方程式(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
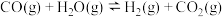 ,该反应平衡常数随温度的变化如下表所示:
,该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
①该反应的化学平衡常数表达式为

②升高温度,该平衡的移动方向是
(3)某温度下,平衡浓度符合下式:
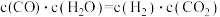 ,试判断此时的温度为
,试判断此时的温度为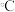 。
。(4)一定条件下,可以由
 和
和 合成
合成 ,同时还生成
,同时还生成 。向恒容密闭容器中充入一定量的
。向恒容密闭容器中充入一定量的 和
和 ,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示:
该温度下的的平衡常数等于
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Cu及化合物在生产、国防中有重要的应用。
I.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:Cu2O(s)+ O2(g)=2CuO(s) ΔH=-196kJ/mol
O2(g)=2CuO(s) ΔH=-196kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-220.8kJ/mol
则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为___ 。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
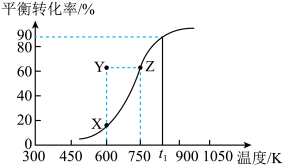
①该反应的ΔH___ 0(填“>”或“<”);600K时,Y点甲醇的v(正)___ v(逆)(填“>”或“<”)。
②在t1K时,向固定体积为1L的密闭容器中充入2molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)___ ,温度为t1时,该反应的平衡常数K的值为___ 。
II.Cu既是常见的催化剂,又是常见的电极材料。
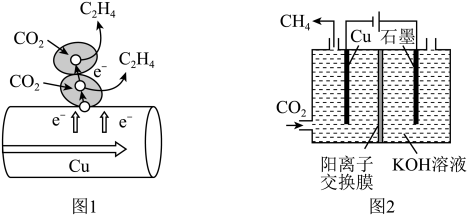
(3)图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当直接传递的电子物质的量为2mol时,则参加反应的CO2的物质的量为___ 。
(4)图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为___ 。
III.含铜离子的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
(5)已知:Ksp(CuS)=1×10-36,要使铜离子的浓度符合排放标准(不超过0.4mg/L),溶液中的硫离子的物质的量浓度至少为___ mol/L(保留至小数点后一位)。
I.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:Cu2O(s)+
 O2(g)=2CuO(s) ΔH=-196kJ/mol
O2(g)=2CuO(s) ΔH=-196kJ/mol2C(s)+O2(g)=2CO(g) ΔH=-220.8kJ/mol
则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:CH3OH(g)
 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
①该反应的ΔH
②在t1K时,向固定体积为1L的密闭容器中充入2molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)
II.Cu既是常见的催化剂,又是常见的电极材料。

(3)图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当直接传递的电子物质的量为2mol时,则参加反应的CO2的物质的量为
(4)图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为
III.含铜离子的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
(5)已知:Ksp(CuS)=1×10-36,要使铜离子的浓度符合排放标准(不超过0.4mg/L),溶液中的硫离子的物质的量浓度至少为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】二甲醚简称DME,是一种基础化工原料,可用于燃料电池及制取低碳烯烃等,Kagan提出的一步法制取二甲醚的反应为: ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
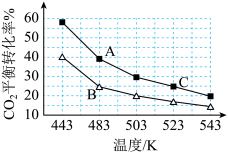
(1)ΔH_______ 0(填“>”或“<”)。进料浓度比c(H2)∶c(CO2)=5的曲线为_______ 点所在曲线(填“A”或“B”),B、C两点用CH3OCH3表示的平均反应速率 (B)
(B)_______  (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。
(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应: 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是_______ 。
(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是_______ 、_______ 。
(4)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)
不能说明该反应已达到平衡状态标志的是_______ (填标号)。
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(5)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g) N2O4(g),n(NO2)随时间的变化如表:
N2O4(g),n(NO2)随时间的变化如表:
根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是_______ 。该温度下,反应2NO2(g)  N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=_______ L·mol-1。
(6)对于反应2NO2(g) N2O4(g),用平衡时各组分压强关系表达的平衡常数
N2O4(g),用平衡时各组分压强关系表达的平衡常数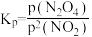 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
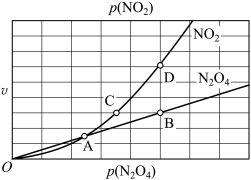
一定温度下,k1、k2与平衡常数KP的关系是k1=_______ 。在图标出的点中,指出能表示反应达到平衡状态的点并说明理由_______ 。
 ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
(1)ΔH
 (B)
(B) (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应:
 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是
(4)在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)
 5N2(g)+6H2O(g)
5N2(g)+6H2O(g)不能说明该反应已达到平衡状态标志的是
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(5)一定温度下,在2 L恒容密闭容器内发生反应2NO2(g)
 N2O4(g),n(NO2)随时间的变化如表:
N2O4(g),n(NO2)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2) /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=(6)对于反应2NO2(g)
 N2O4(g),用平衡时各组分压强关系表达的平衡常数
N2O4(g),用平衡时各组分压强关系表达的平衡常数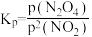 。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
一定温度下,k1、k2与平衡常数KP的关系是k1=
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】I.用0.1 mol/LNaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
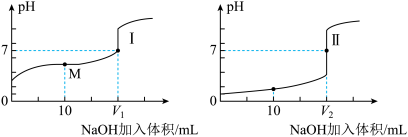
(1)滴定醋酸的曲线是_______ (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______ 。
(3)V1和V2的关系: V1_______ V2 (填“>”、“=”或“<”)。
(4)M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______ 。
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号______ ,该错误操作会导致测定结果______ (填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____ 中。(从图中选填“甲”或“乙”)
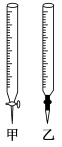
(3)下列操作会引起实验结果偏大的是:_______ (填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从____ 色变为____ 色,且半分钟之内不再改变。
(5)以下是实验数据记录表
通过计算可得,该盐酸浓度为:_______ mol·L-1(计算结果保留2位小数)。

(1)滴定醋酸的曲线是
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的是
(3)V1和V2的关系: V1
(4)M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入

(3)下列操作会引起实验结果偏大的是:
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从
(5)以下是实验数据记录表
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 16.30 |
| 2 | 20.00 | 0.00 | 16.22 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.按要求填空:
(1)浓度均为0.1mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵,四种溶液中由水电离出的H+浓度由大到小的顺序是________ (填序号)。
(2)现将足量的固体AgCl分别放入下列物质中:①30mL0.02mol/LCaCl2溶液 ②20mL0.01mol/LKCl溶液 ③40mL0.03mol/LHCl溶液 ④10mL蒸馏水 ⑤50mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的排列顺序是______ (填序号)。
(3)Na2CO3溶液中离子浓度由大到小的顺序为________ 。
(4)CuSO4溶液中含有Fe2(SO4)3杂质,除杂试剂为________ 。
(5)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________ 。
(6)将25℃下pH=12的Ba(OH)2溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=________ 。(溶液体积变化忽略不计)。
II.常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________ 。
(2)Na2A的水溶液呈________ 性,原因是(用离子方程式表示):________ 。
(3)若溶液M由2mol/LH2A溶液与2mol/LNaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为________ 。
(4)已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为_______ mol·L-1。(忽略A2-的水解)
(1)浓度均为0.1mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵,四种溶液中由水电离出的H+浓度由大到小的顺序是
(2)现将足量的固体AgCl分别放入下列物质中:①30mL0.02mol/LCaCl2溶液 ②20mL0.01mol/LKCl溶液 ③40mL0.03mol/LHCl溶液 ④10mL蒸馏水 ⑤50mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的排列顺序是
(3)Na2CO3溶液中离子浓度由大到小的顺序为
(4)CuSO4溶液中含有Fe2(SO4)3杂质,除杂试剂为
(5)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理
(6)将25℃下pH=12的Ba(OH)2溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=
II.常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式
(2)Na2A的水溶液呈
(3)若溶液M由2mol/LH2A溶液与2mol/LNaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为
(4)已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)物质的量浓度相等的以下五种溶液 ①NaCl、②NaOH、③HCl、④CH3COOH、⑤CH3COONa,这5种溶液按pH由大到小的顺序为:_________________ (填序号);pH相同、体积相等的③和④溶液,分别与等浓度的NaOH溶液发生中和反应,消耗NaOH溶液体积多的是_____________ (填序号)。
(2)常温下,pH=12的CH3COONa溶液中,水电离出来的c(OH-)=______ mol/L;pH=2的CH3COOH溶液中,醋酸的电离常数表达式___________ ,该溶液中水电离出来的c(H+)=______ mol/L,。
(3)室温下,pH=3的盐酸溶液与pH=11氨水等体积混合后pH______ 7(填“>”“<”或“=”)
(4)实验室配置FeCl3溶液,需要向配好的溶液里加一种酸,该酸是_________ (填化学式),其作用__________________ 。
(2)常温下,pH=12的CH3COONa溶液中,水电离出来的c(OH-)=
(3)室温下,pH=3的盐酸溶液与pH=11氨水等体积混合后pH
(4)实验室配置FeCl3溶液,需要向配好的溶液里加一种酸,该酸是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知常温下,几种电解质的电离平衡常数如表所示:
回答下列问题:
(1)在NaClO溶液中滴加几滴酚酞,可能的现象是_______ 。
(2)常温下,在醋酸溶液中加蒸馏水, 将
将 _______ (填“增大”“减小”或“不变”)。
(3)常温下,体积均为200mL、物质的量浓度相等的下列三种溶液:①NaCl溶液;②CH3COONa溶液;③NaClO溶液。其中离子总数由大到小的排序为_______ (填序号)。
(4)NaClO溶液通入少量CO2,离子方程式为_______ 。
(5)NH4HCO3溶液中NH 、HCO
、HCO 、H+、OH﹣离子浓度大小排序
、H+、OH﹣离子浓度大小排序 _______ 。
(6)温下,向100mL0.1mol•L﹣1NaOH溶液中缓缓通入CO2使6c(HCO )=c(CO
)=c(CO )时,溶液pH=
)时,溶液pH=_______ 。
(7)体积均为10mL且pH均为2醋酸溶液与一元酸HX溶液,分别加水稀释至1000mL,稀释过程中的pH变化如图所示,则相同条件下HX的电离平衡常数_______ 醋酸的电离平衡常数(填“大于”“小于”或“等于”,下同)。等浓度的CH3COONa溶液、NaX溶液,前者的阴离子浓度之和 _______ 后者的阴离子浓度之和。

| 电解质 | HClO | NH3•H2O | H2CO3 | CH3COOH |
| Ka或Kb | 3.0×10﹣8 | 1.8×10﹣5 | Ka1=4.0×10﹣7 Ka2=6.0×10﹣11 | 1.8×10﹣5 |
(1)在NaClO溶液中滴加几滴酚酞,可能的现象是
(2)常温下,在醋酸溶液中加蒸馏水,
 将
将 (3)常温下,体积均为200mL、物质的量浓度相等的下列三种溶液:①NaCl溶液;②CH3COONa溶液;③NaClO溶液。其中离子总数由大到小的排序为
(4)NaClO溶液通入少量CO2,离子方程式为
(5)NH4HCO3溶液中NH
 、HCO
、HCO 、H+、OH﹣离子浓度大小排序
、H+、OH﹣离子浓度大小排序 (6)温下,向100mL0.1mol•L﹣1NaOH溶液中缓缓通入CO2使6c(HCO
 )=c(CO
)=c(CO )时,溶液pH=
)时,溶液pH=(7)体积均为10mL且pH均为2醋酸溶液与一元酸HX溶液,分别加水稀释至1000mL,稀释过程中的pH变化如图所示,则相同条件下HX的电离平衡常数

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(1)按系统命名法,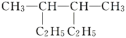 的名称是:
的名称是:___________ 。
(2)已知丙烯的标准燃烧热为2058 kJ·mol-1,请写出丙烯燃烧的热化学方程式___________ 。
(3)水的自偶电离方程式为2H2O OH−+ H3O +,液氨也存在与水类似的自偶电离,写出液氨的自偶电离方程式
OH−+ H3O +,液氨也存在与水类似的自偶电离,写出液氨的自偶电离方程式___________ 。结合H+能力的相对强弱:OH−___________ (填“>”“<””或“=”)NH 。
。
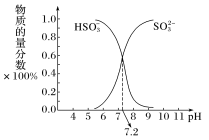
(4)在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO 的水解平衡常数=
的水解平衡常数=___________ 。
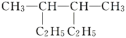 的名称是:
的名称是:(2)已知丙烯的标准燃烧热为2058 kJ·mol-1,请写出丙烯燃烧的热化学方程式
(3)水的自偶电离方程式为2H2O
 OH−+ H3O +,液氨也存在与水类似的自偶电离,写出液氨的自偶电离方程式
OH−+ H3O +,液氨也存在与水类似的自偶电离,写出液氨的自偶电离方程式 。
。(4)在某NaHSO3、Na2SO3混合溶液中HSO
 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分),根据图示,求SO 的水解平衡常数=
的水解平衡常数=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)已知25 ℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下1 mol·L-1的NH4Cl溶液中c(H+)=_______ mol·L-1.(已知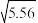 ≈2.36)。
≈2.36)。
(2)磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13。
①Na2HPO4的水溶液呈_______ (填“酸”“碱”或“中”)性。
②下列说法正确的是_______
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中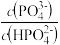 的值增大
的值增大
D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
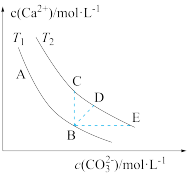
(3)不同温度下(T1、T2),CaCO3在水中的沉淀溶解平衡曲线如图所示,回答下列问题(注:CaCO3均未完全溶解)T1_______ (填“>”“<”或“=”)T2;在B点,若温度从T1到T2,则B点变到_______ 点(填“C”“D”或“E”。)
(4)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为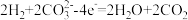 。正极的电极反应为
。正极的电极反应为_______ 。
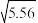 ≈2.36)。
≈2.36)。(2)磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13。
①Na2HPO4的水溶液呈
②下列说法正确的是
A.磷酸溶液中存在3个平衡
B.向pH=2的磷酸溶液中加入NaH2PO4固体,溶液酸性降低
C.向Na2HPO4溶液中滴加稀盐酸的过程中
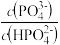 的值增大
的值增大 D.向NaH2PO4溶液中滴加NaOH至过量,水的电离程度先增大后减小
(3)不同温度下(T1、T2),CaCO3在水中的沉淀溶解平衡曲线如图所示,回答下列问题(注:CaCO3均未完全溶解)T1

(4)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中
 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为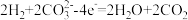 。正极的电极反应为
。正极的电极反应为
您最近半年使用:0次



