1 . 丙烯是三大合成材料的基本原料之一。可以用丙烷直接脱氢、丙烷氧化脱氢和电解法制丙烯。已知下列反应的热化学方程式:
直接脱氢ⅰ: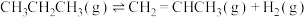
 kJ⋅mol
kJ⋅mol
氧化脱氢ⅱ: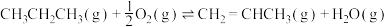
ⅲ: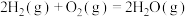
 kJ⋅mol
kJ⋅mol
(1)
______ kJ⋅mol 。
。
(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率x与平衡常数 的关系可表示为:
的关系可表示为: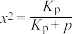 ,式中p为系统总压。p分别为a MPa和b MPa时(
,式中p为系统总压。p分别为a MPa和b MPa时( ),丙烯平衡产率与温度的关系如图1所示。
),丙烯平衡产率与温度的关系如图1所示。______ (填“Ⅰ”或“Ⅱ”), ℃时,
℃时,
______ MPa。
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是____________ 。
③立方ZnO的晶胞如下图2所示,则该晶体中 的配位数为
的配位数为______ ;晶胞参数为cpm, 与
与 间的最小距离为
间的最小距离为______ pm。
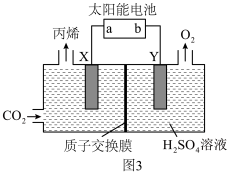
(3)以惰性材料作电极,电解法制取丙烯的原理如图3所示。______ 极(填“阳”或“阴”)。
②若电解生成1mol丙烯,理论上阳极区溶液减少的质量为______ g。
直接脱氢ⅰ:
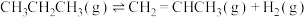
 kJ⋅mol
kJ⋅mol
氧化脱氢ⅱ:
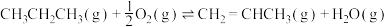
ⅲ:
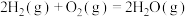
 kJ⋅mol
kJ⋅mol
(1)

 。
。(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率x与平衡常数
 的关系可表示为:
的关系可表示为: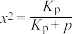 ,式中p为系统总压。p分别为a MPa和b MPa时(
,式中p为系统总压。p分别为a MPa和b MPa时( ),丙烯平衡产率与温度的关系如图1所示。
),丙烯平衡产率与温度的关系如图1所示。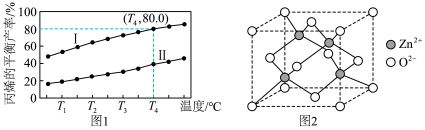
 ℃时,
℃时,
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是
③立方ZnO的晶胞如下图2所示,则该晶体中
 的配位数为
的配位数为 与
与 间的最小距离为
间的最小距离为(3)以惰性材料作电极,电解法制取丙烯的原理如图3所示。
②若电解生成1mol丙烯,理论上阳极区溶液减少的质量为
您最近一年使用:0次
名校
2 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用且能够更好地保护环境,请回答下列问题:
(1)以下是N2(g)+3H2(g)⇌2NH3(g)( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:
①提高该化学反应限度的途径是_______ 。
A、降低压强 B、增大压强 C、增大温度 D、降低温度E、催化剂
②根据表中数据, 含量达到98.8%的条件是
含量达到98.8%的条件是_______ ,而实际工业生产通常选择温度400~500℃,原因是_______ ,压强选择10MPa~30MPa,原因是_______ 。
(2)在密闭容器中,充入一定量的N2、H2,在一定条件下反应,已知NH3的体积分数(纵坐标)和温度(横坐标)的变化关系如图所示,下列说法正确的是_______ 。
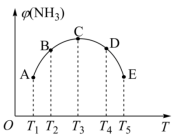
A、平衡常数K:A点<B点
B、H2的转化率C点最高
C、A、B、C、D、E五点都达到了平衡状态
(3)过渡施用氮肥将导致大气中 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
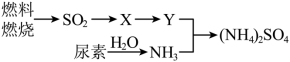
①X可能是 或
或_______ ,Y是_______ 。
②尿素 是一种常用有机氮肥,能缓慢与
是一种常用有机氮肥,能缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为_______ 。
(1)以下是N2(g)+3H2(g)⇌2NH3(g)(
 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:温度/℃ NH3含量/% 压强/MPa | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A、降低压强 B、增大压强 C、增大温度 D、降低温度E、催化剂
②根据表中数据,
 含量达到98.8%的条件是
含量达到98.8%的条件是(2)在密闭容器中,充入一定量的N2、H2,在一定条件下反应,已知NH3的体积分数(纵坐标)和温度(横坐标)的变化关系如图所示,下列说法正确的是

A、平衡常数K:A点<B点
B、H2的转化率C点最高
C、A、B、C、D、E五点都达到了平衡状态
(3)过渡施用氮肥将导致大气中
 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)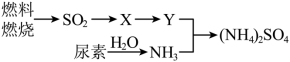
①X可能是
 或
或②尿素
 是一种常用有机氮肥,能缓慢与
是一种常用有机氮肥,能缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 乙醇与水催化反应可以制得氢气。
(1)已知: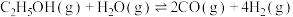
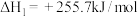 ,回答下列问题:
,回答下列问题:
①升温,平衡_______ 移动(填“向左”、“向右”、“不”);
②与原平衡相比较,增大压强,新平衡时
_______ (填“增大”、“减小”、“不变”,下同);
③恒温、恒容条件下。加入水蒸气,转化率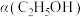
_______ ;
④恒温、恒压条件下,加入稀有气体,体积分数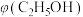
_______ 。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I: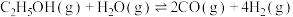
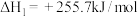
反应II:

反应III:

则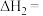
_______  。
。
(3)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时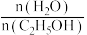 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
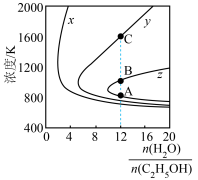
 的平衡产率:B点
的平衡产率:B点_______ C点(填“>”或“<”)。
(4)恒容条件下,将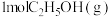 和
和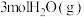 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
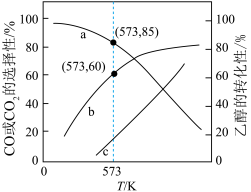
【已知:CO的选择性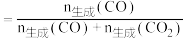 】
】
①表示乙醇转化率的曲线是_______ (填“a”、“b”或“c”)。
②573K时,反应II的压强平衡常数
_______ 。(已知:分压=总压 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
(1)已知:
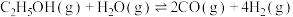
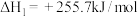 ,回答下列问题:
,回答下列问题:①升温,平衡
②与原平衡相比较,增大压强,新平衡时

③恒温、恒容条件下。加入水蒸气,转化率
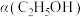
④恒温、恒压条件下,加入稀有气体,体积分数
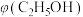
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I:
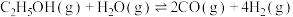
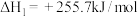
反应II:


反应III:


则
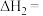
 。
。(3)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时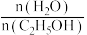 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
 的平衡产率:B点
的平衡产率:B点(4)恒容条件下,将
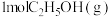 和
和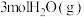 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性
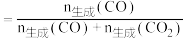 】
】①表示乙醇转化率的曲线是
②573K时,反应II的压强平衡常数

 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
您最近一年使用:0次
2023-11-14更新
|
362次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高二上学期期中考试化学试题
名校
4 . 2023年全国政府工作报告指出,推动重点领域节能降碳减污。萨巴蒂尔反应提出,电解水生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,而水可循环使用,可用于太空生命保障。
(1)一定温度下,在恒容密闭容器发生4H2(g)+CO2(g) CH4(g)+2H2O(g)反应。
CH4(g)+2H2O(g)反应。
①能说明该反应达到平衡状态的是________ (填字母)。
A.H2的浓度保持不变
B.断开1molC=O键的同时生成4mol的C-H键
C.气体平均相对分子质量一定
D.v(CO2)=v(CH4)
②已知容器的容积为10L,初始加入2molCO2和6molH2,反应平衡后测得CO2的转化率为40%,则该反应的平衔常数为________ (只列出计算式即可)。
③保持温度和容积不变,再加入1molCO2(g)和3molH2(g),此时,CO2的转化率________ (填“>”“<”或“=”)40%。
(2)工业上可以利用H2和CO2合成乙醇,其反应为:6H2(g)+2CO2(g) C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。
C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。
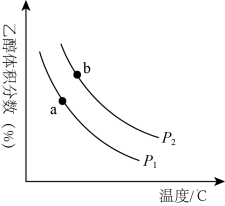
①压强P1________ P2(填“>”、“<”或“=”,下同)。判断依据是_______ 。
②a、b两点的平衡常数Ka________ Kb。
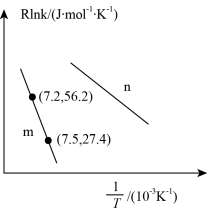
③已知Arhenius经验公式为Rlnk=-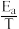 +C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得如图所示曲线。在n催化剂作用下,该反应的活化能Ea
+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得如图所示曲线。在n催化剂作用下,该反应的活化能Ea________ J•mol-1。从图中信息获知催化效率较高的催化剂是________ (填“m”或“n”)。
(1)一定温度下,在恒容密闭容器发生4H2(g)+CO2(g)
 CH4(g)+2H2O(g)反应。
CH4(g)+2H2O(g)反应。①能说明该反应达到平衡状态的是
A.H2的浓度保持不变
B.断开1molC=O键的同时生成4mol的C-H键
C.气体平均相对分子质量一定
D.v(CO2)=v(CH4)
②已知容器的容积为10L,初始加入2molCO2和6molH2,反应平衡后测得CO2的转化率为40%,则该反应的平衔常数为
③保持温度和容积不变,再加入1molCO2(g)和3molH2(g),此时,CO2的转化率
(2)工业上可以利用H2和CO2合成乙醇,其反应为:6H2(g)+2CO2(g)
 C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。
C2H5OH(g)+3H2O(g)。将等物质的量的H2和CO2充入一刚性容器中,测得平衡时C2H5OH的体积分数随温度和压强的变化关系如图所示。
①压强P1
②a、b两点的平衡常数Ka
③已知Arhenius经验公式为Rlnk=-
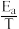 +C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得如图所示曲线。在n催化剂作用下,该反应的活化能Ea
+C(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得如图所示曲线。在n催化剂作用下,该反应的活化能Ea
您最近一年使用:0次
名校
解题方法
5 . 工业上常以黄铁矿( )为原料制备硫酸,硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等。接触法制硫酸生产中的关键工序是
)为原料制备硫酸,硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等。接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: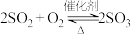 ,其流程如图所示:
,其流程如图所示:

(1)“吸收”过程中吸收液(浓硫酸)从上向下喷,目的是___________ 。
(2)“接触室”中,在温度为400~500℃时, 的催化氧化采用常压而不是高压,主要原因是
的催化氧化采用常压而不是高压,主要原因是___________ 。
(3)其催化氧化的能量变化如图所示,该过程的热化学方程式为___________ 。

已知: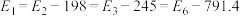
(4)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是___________ (填标号)。

(5)向体积可变的密闭容器中加入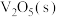 、
、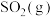 各0.6mol、
各0.6mol、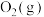 0.3mol,此时容器的体积为10L(忽略容器中固体体积),保持恒压的条件下分别在
0.3mol,此时容器的体积为10L(忽略容器中固体体积),保持恒压的条件下分别在 、
、 、
、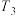 三种温度下进行反应,测得容器中
三种温度下进行反应,测得容器中 的转化率如图所示。
的转化率如图所示。

①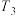 温度下反应速率最慢的原因可能是
温度下反应速率最慢的原因可能是___________ 。
② 温度时,反应达到平衡时容器的体积为
温度时,反应达到平衡时容器的体积为___________ L,反应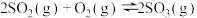 的平衡常数K=
的平衡常数K=___________ 。
 )为原料制备硫酸,硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等。接触法制硫酸生产中的关键工序是
)为原料制备硫酸,硫酸是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等。接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: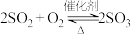 ,其流程如图所示:
,其流程如图所示:
(1)“吸收”过程中吸收液(浓硫酸)从上向下喷,目的是
(2)“接触室”中,在温度为400~500℃时,
 的催化氧化采用常压而不是高压,主要原因是
的催化氧化采用常压而不是高压,主要原因是(3)其催化氧化的能量变化如图所示,该过程的热化学方程式为

已知:
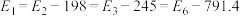
(4)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是

(5)向体积可变的密闭容器中加入
 、
、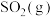 各0.6mol、
各0.6mol、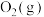 0.3mol,此时容器的体积为10L(忽略容器中固体体积),保持恒压的条件下分别在
0.3mol,此时容器的体积为10L(忽略容器中固体体积),保持恒压的条件下分别在 、
、 、
、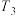 三种温度下进行反应,测得容器中
三种温度下进行反应,测得容器中 的转化率如图所示。
的转化率如图所示。
①
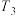 温度下反应速率最慢的原因可能是
温度下反应速率最慢的原因可能是②
 温度时,反应达到平衡时容器的体积为
温度时,反应达到平衡时容器的体积为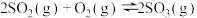 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
2023-08-11更新
|
158次组卷
|
3卷引用:重庆市第七中学校2023-2024学年高三上学期第一次月考化学试题
6 .  可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
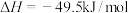
反应2:
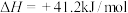 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________ 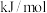 。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在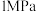 、
、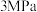 、
、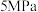 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。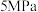 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。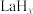 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
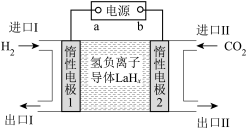
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率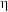 为
为___________ (
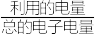 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

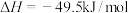
反应2:

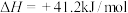 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
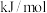 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在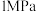 、
、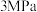 、
、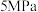 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
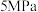 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是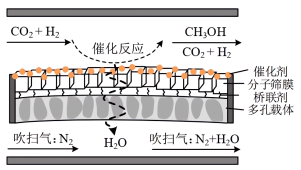
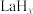 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率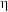 为
为
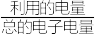 ×100%)。
×100%)。
您最近一年使用:0次
2023-06-03更新
|
691次组卷
|
5卷引用:重庆市巴蜀中学校2023学年高三模拟预测化学试题
重庆市巴蜀中学校2023学年高三模拟预测化学试题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)广西名校2023-2024学年高三上学期仿真卷(一)化学试题湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题
名校
7 . 为实现“碳达峰”、“碳中和”目标,可将CO2催化加氢制甲醇。该反应体系中涉及以下两个主要反应:
反应I: △H1<0
△H1<0
反应II: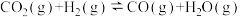 △H2>0
△H2>0
(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
则反应I的
_______ 。
(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
(3)向容器中加入1mol CO2、1mol H2,维持压强100kpa发生反应,CO2和H2的平衡转化率随温度变化曲线如图所示。

①曲线_______ (填“L1”或“L2”)表示CO2的平衡转化率。
②温度高于T2K后曲线L2随温度升高而降低的原因为_______ 。
③T1K下反应达到平衡时,H2O(g)的物质的量为_______ mol,反应I的标准平衡常数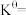
_______ (保留1位小数)。(已知:分压=总压×该组分物质的量分数,对于反应: ,
,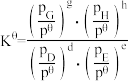 ,其中
,其中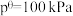 ,
,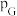 、
、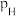 、
、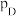 、
、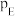 为各组分的平衡分压)。
为各组分的平衡分压)。
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:
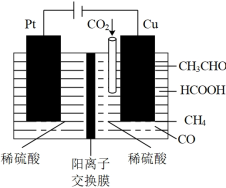
①铜电极上产生CH4的电极反应式为_______ 。
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为_______ 。
反应I:
 △H1<0
△H1<0反应II:
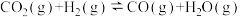 △H2>0
△H2>0(1)已知101kPa和298K时一些物质的标准摩尔生成热(在101kPa和一定温度下,由最稳定单质生成1mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
| 物质 | H2(g) | CO2(g) | CH3OH(g) | H2O(g) |
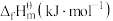 | 0 | -393.5 | -201 | -241.8 |

(2)在密闭容器中上述反应混合体系建立平衡后,下列说法正确的是_______。
| A.增大压强,CO的浓度一定保持不变 |
| B.降低温度,反应II的逆反应速率增大,正反应速率减小 |
| C.增大 CH3OH的浓度,反应II的平衡向正反应方向移动 |
| D.恒温恒压下充入气,反应I的平衡向逆反应方向移动 |

①曲线
②温度高于T2K后曲线L2随温度升高而降低的原因为
③T1K下反应达到平衡时,H2O(g)的物质的量为
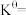
 ,
,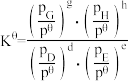 ,其中
,其中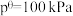 ,
,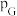 、
、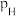 、
、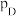 、
、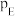 为各组分的平衡分压)。
为各组分的平衡分压)。(4)利用电催化可将CO2同时转化为多种燃料,装置如图:

①铜电极上产生CH4的电极反应式为
②5.6L(标准状况下) CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g,则生成CO和CH4的体积比为
您最近一年使用:0次
名校
解题方法
8 . 现代煤化工产生大量H2S废气,其回收利用有重要意义。
I.热解H2S制H2。
(1)已知下列反应的热化学方程式:
①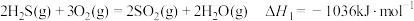
②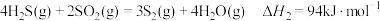
③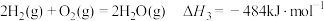
判断H2S热分解反应④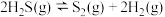 活化能
活化能
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)在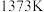 、
、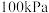 反应条件下,对于
反应条件下,对于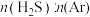 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的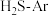 混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
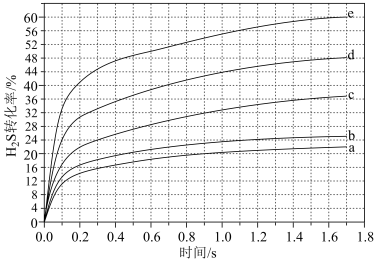
①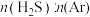 越大,H2S平衡转化率
越大,H2S平衡转化率_______ ,理由是_______ 。
②计算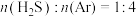 时,在
时,在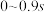 之间,H2S分压的平均变化率为
之间,H2S分压的平均变化率为_______ 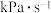 。
。
II.H2S可转化成羰基硫(COS):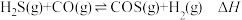 。
。
(3)绝热恒压条件下,密闭容器中充入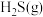 与
与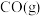 进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
(4)T℃下,将物质的量之比为2:1的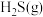 与
与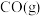 充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为
充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为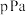 ,
,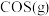 的体积分数为10%。则此时该反应的平衡常数
的体积分数为10%。则此时该反应的平衡常数
_______ (保留2位有效数字)。
III.用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为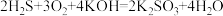
(5)电池的负极电极反应式为_______ 。
(6)若电池开始工作时每 电解质溶液含
电解质溶液含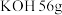 。取电池工作一段时间后的电解质溶液
。取电池工作一段时间后的电解质溶液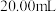 ,加入
,加入 溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为
溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为 ,计算电池工作的这段时间内至少通入了标况下的氧气约
,计算电池工作的这段时间内至少通入了标况下的氧气约_______ L。
I.热解H2S制H2。
(1)已知下列反应的热化学方程式:
①
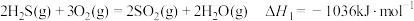
②
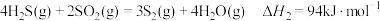
③
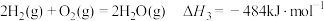
判断H2S热分解反应④
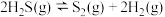 活化能
活化能
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)在
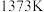 、
、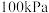 反应条件下,对于
反应条件下,对于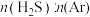 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的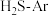 混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
①
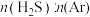 越大,H2S平衡转化率
越大,H2S平衡转化率②计算
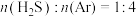 时,在
时,在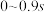 之间,H2S分压的平均变化率为
之间,H2S分压的平均变化率为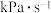 。
。II.H2S可转化成羰基硫(COS):
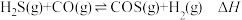 。
。(3)绝热恒压条件下,密闭容器中充入
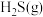 与
与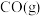 进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。| A.混合气体的平均相对分子质量不再改变 |
B.生成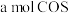 ,同时形成 ,同时形成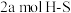 键 键 |
| C.化学平衡常数不再改变 |
| D.混合气体的密度不再改变 |
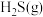 与
与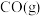 充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为
充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为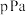 ,
,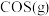 的体积分数为10%。则此时该反应的平衡常数
的体积分数为10%。则此时该反应的平衡常数
III.用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为
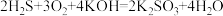
(5)电池的负极电极反应式为
(6)若电池开始工作时每
 电解质溶液含
电解质溶液含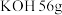 。取电池工作一段时间后的电解质溶液
。取电池工作一段时间后的电解质溶液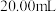 ,加入
,加入 溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为
溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为 ,计算电池工作的这段时间内至少通入了标况下的氧气约
,计算电池工作的这段时间内至少通入了标况下的氧气约
您最近一年使用:0次
名校
9 . Ⅰ、用乙醇与异丁烯(以IB表示)在催化剂HZSM﹣5催化下合成乙基叔丁基醚(以ETBE表示),化学方程式为:C2H5OH(g)+IB(g)⇌ETBE(g),反应物被催化剂HZSM﹣5吸附的顺序与反应历程的关系如图:
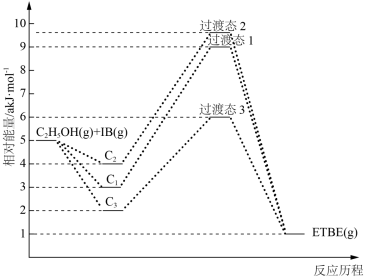
C1表示先吸附乙醇,C2表示先吸附异丁烯,
C3表示乙醇和异丁烯同时吸附
(1)该反应的ΔH=___________ akJ•mol-1,反应历程的最快途径是___________ (填C1、C2或C3)。
Ⅱ、近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,提高原子利用率。其合成的基本反应如下:CH2=CH2(g)+CH3COOH(1) CH3COOC2H5(1)
CH3COOC2H5(1)
(2)下列描述能说明体积固定容器中乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是___________。
(3)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。
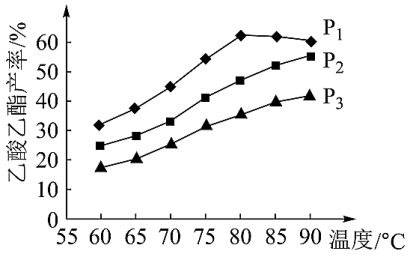
①温度在60~90℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是___________ [用v(P1)、v(P2)、v(P3)分别表示不同压强下的反应速率]。
②在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________ 。
③根据测定实验结果分析,较适宜的生产条件是___________ (填合适的压强和温度)。
(4)已知该反应的标准平衡常数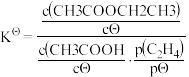 ,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在恒温80℃和恒压105kPa条件下反应,乙酸乙酯的平衡产率为80%,则KΘ=
,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在恒温80℃和恒压105kPa条件下反应,乙酸乙酯的平衡产率为80%,则KΘ=___________ 。

C1表示先吸附乙醇,C2表示先吸附异丁烯,
C3表示乙醇和异丁烯同时吸附
(1)该反应的ΔH=
Ⅱ、近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,提高原子利用率。其合成的基本反应如下:CH2=CH2(g)+CH3COOH(1)
 CH3COOC2H5(1)
CH3COOC2H5(1)(2)下列描述能说明体积固定容器中乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是___________。
| A.乙酸、乙酸乙酯的浓度相同 |
| B.酯化合成反应的速率与酯分解反应的速率相等 |
| C.体系中气体密度一定 |
| D.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |

①温度在60~90℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是
②在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是
③根据测定实验结果分析,较适宜的生产条件是
(4)已知该反应的标准平衡常数
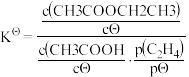 ,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在恒温80℃和恒压105kPa条件下反应,乙酸乙酯的平衡产率为80%,则KΘ=
,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在恒温80℃和恒压105kPa条件下反应,乙酸乙酯的平衡产率为80%,则KΘ=
您最近一年使用:0次
名校
10 . Ⅰ.滴定实验是化学学科中重要的定量实验。除了酸碱中和滴定以外,还有其他应用:
(一)氧化还原滴定
取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
(1)滴定时,KMnO4溶液应装在____ (“酸”或“碱”)式滴定管中,滴定终点时滴定现象是____ 。
(2)该草酸溶液的物质的量浓度为____ 。
(3)下列操作会使测量结果偏低的是____ 。
(二)沉淀滴定:滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(4)参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是____ (填字母)。
(5)若标准滴定管的读数如图,则消耗溶液的体积为____ mL。

Ⅱ.一定条件下在密闭容器内合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。
CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。

(6)平衡常数K(M )____ K(N)。(填>、<、=)
(7)两点反应速率关系为:M____ N(填大于、小于、等于、均有可能)。
(8)250℃,欲提高H2的转化率,可以采取的措施为____ 。
A.升温 B.再加入催化剂 C.增加CO2浓度 D.加入H2 E.加入惰性气体 F.分离出H2O
(一)氧化还原滴定
取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
(2)该草酸溶液的物质的量浓度为
(3)下列操作会使测量结果偏低的是
| A.滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失 |
| B.滴定过程中由于振荡过于剧烈,使锥形瓶中少量溶液溅出 |
| C.滴定前平视液面,滴定后俯视液面 |
| D.滴定过程中,用蒸馏水冲洗溅到锥形瓶侧壁上的溶液,并继续滴定 |
(二)沉淀滴定:滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(4)参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
| A.NaCl | B.NaBr | C.NaCN | D.Na2CrO4 |

Ⅱ.一定条件下在密闭容器内合成乙烯:6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。
CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图。
(6)平衡常数K(M )
(7)两点反应速率关系为:M
(8)250℃,欲提高H2的转化率,可以采取的措施为
A.升温 B.再加入催化剂 C.增加CO2浓度 D.加入H2 E.加入惰性气体 F.分离出H2O
您最近一年使用:0次



