名校
1 . Ⅰ.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
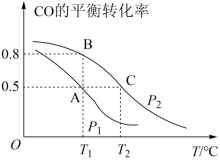
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是___________ ;平衡常数K=___________ 。平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大”、“不变”成“减小”),CO与CH3OH的浓度比
___________ (填“增大”、“不变”或“减小”)。
(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)若p2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s) PH3(g)+HI(g)
PH3(g)+HI(g)
②4PH3(g) P4(g)+6H2(g)
P4(g)+6H2(g)
③2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将___________ (填“增加”、“减小”或“不变”)。
(5)平衡后容器内P4(g)的物质的量___________ 。
(6)求反应①的K___________ 。
 CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
(1)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。平衡时H2的体积分数是

(2)若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
(3)若p2压强恒定为p,则平衡常数Kp=
Ⅱ.在真空1L密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
①PH4I(s)
 PH3(g)+HI(g)
PH3(g)+HI(g) ②4PH3(g)
 P4(g)+6H2(g)
P4(g)+6H2(g) ③2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)以上三个反应建立平衡后,测得HI为bmol,I2为cmol,H2为dmol。
(4)平衡后,增大压强,容器内n(I2)将
(5)平衡后容器内P4(g)的物质的量
(6)求反应①的K
您最近一年使用:0次
名校
解题方法
2 . 研究氮氧化物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.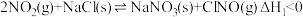
Ⅱ.
①反应: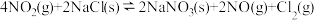 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正)___________  (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。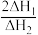 的数值范围是
的数值范围是___________ (填序号)。
A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时
___________ mol,Ⅱ的压强平衡常数
___________ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(2)CO还原氮氧化物的反应如下: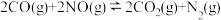
 。
。
①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。
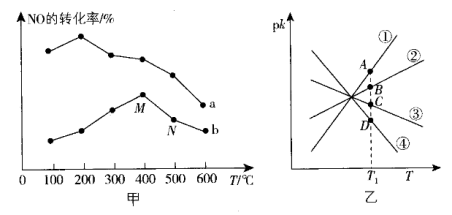
在催化剂作用下,图中M点___________ (填“达到了”或“未达到”)平衡状态。温度高于400℃,NO转化率降低的原因可能是___________ 。
②实验测得 (
( 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示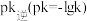 随温度变化的是
随温度变化的是___________ (填序号)升高温度,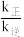
___________ (填“增大”“减小”或“不变”)图中 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
___________ L/mol。
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将___________ (填“正向移动”“逆向移动”或“不移动”)。
(1)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ.
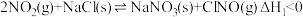
Ⅱ.

①反应:
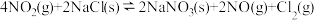 只有在低温时自发进行,则该反应的活化能:
只有在低温时自发进行,则该反应的活化能: (正)
(正) (逆)(填“>”或“<”),。
(逆)(填“>”或“<”),。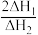 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
②为研究上述反应体系的平衡关系,恒温条件下,向盛有足量NaCl(s)的恒容密闭容器中加入0.2mol
 、0.2molNO和0.1mol
、0.2molNO和0.1mol ,初始压强为
,初始压强为 ,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%,
,只发生反应Ⅰ、Ⅱ,达到平衡时测得体系的压强减少20%, 的平衡转化率为20%,则平衡反应时
的平衡转化率为20%,则平衡反应时

 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(2)CO还原氮氧化物的反应如下:
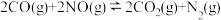
 。
。①该反应分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图甲所示。

在催化剂作用下,图中M点
②实验测得
 (
( 是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示
是速率常数,只与温度有关)。如图乙所示①②③④四条斜线中,能表示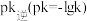 随温度变化的是
随温度变化的是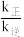
 点的纵坐标分别为
点的纵坐标分别为 ,则温度T1时化学平衡常数
,则温度T1时化学平衡常数
③同温同压下,再向该容器中注入稀有气体氦气,该反应的化学平衡将
您最近一年使用:0次
名校
解题方法
3 . 以CO2和NH3为原料合成尿素有利于实现“碳达峰、碳中和”,该体系中同时存在以下反应:
Ⅰ.2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159kJ·mol-1
NH2COONH4(s) ΔH1=-159kJ·mol-1
Ⅱ.2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2
Ⅲ.NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=___________ kJ·mol-1,ΔS___________ 0(填“>”或“<”)。
(2)一定温度下,按物质的量之比为2:1通入NH3和CO2至密闭容器中,假设仅发生反应Ⅰ。达到平衡后,CO2的平衡浓度为c1mol·L-1,其他条件不变,缩小容器容积,重新达到平衡后,CO2的平衡浓度为c2mol·L-1,则c1___________ c2(填“>”、“<”或“=”)。
(3)为研究上述三个反应的平衡关系,通入3mol的NH3、CO2混合气体至10L恒容密闭容器中,NH3的平衡分压随初始充入NH3与CO2的物质的量之比、温度的变化关系如图所示。
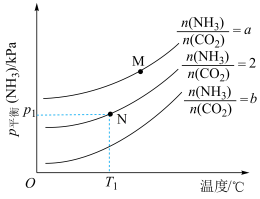
①a___________ b(填“>”或“<”)。
②M点的p平衡(NH3)大于N点的p平衡(NH3),原因为___________ (答一点)。
③T1℃时,反应前容器内气体压强为p0kPa,达到N点对应平衡状态的时间为tmin,则0~tmin时段反应的平均速率v(CO2)=___________ mol·L-1·min-1(用代数式表示)。保持温度不变,平衡后再向容器中通入一定量的水蒸气,NH2COONH4的平衡产率___________ (填“增大”、“减小”或“不变”)。
Ⅰ.2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH1=-159kJ·mol-1
NH2COONH4(s) ΔH1=-159kJ·mol-1Ⅱ.2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2Ⅲ.NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1回答下列问题:
(1)反应Ⅱ的ΔH2=
(2)一定温度下,按物质的量之比为2:1通入NH3和CO2至密闭容器中,假设仅发生反应Ⅰ。达到平衡后,CO2的平衡浓度为c1mol·L-1,其他条件不变,缩小容器容积,重新达到平衡后,CO2的平衡浓度为c2mol·L-1,则c1
(3)为研究上述三个反应的平衡关系,通入3mol的NH3、CO2混合气体至10L恒容密闭容器中,NH3的平衡分压随初始充入NH3与CO2的物质的量之比、温度的变化关系如图所示。

①a
②M点的p平衡(NH3)大于N点的p平衡(NH3),原因为
③T1℃时,反应前容器内气体压强为p0kPa,达到N点对应平衡状态的时间为tmin,则0~tmin时段反应的平均速率v(CO2)=
您最近一年使用:0次
2023-12-11更新
|
144次组卷
|
2卷引用:河南省顶级名校2023-2024学年高三上学期12月教学质量测评理科综合试题
名校
解题方法
4 . 我国政府承诺二氧化碳排放在2030年前达到峰值,2060年前实现碳中和,彰显作为大国的担当和责任。 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为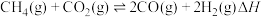 。回答下列问题:
。回答下列问题:
(1)已知:①
②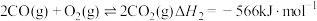
③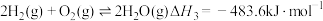
则
___________  。
。
(2)恒容密闭容器中可逆反应 达到平衡状态的标志是___________(填序号)。
达到平衡状态的标志是___________(填序号)。
(3)容器容积为1L,控制 和
和 初始投料量分别为2mol和3mol,发生反应:
初始投料量分别为2mol和3mol,发生反应: ,甲烷的平衡转化率与温度、压强的关系如图甲所示。
,甲烷的平衡转化率与温度、压强的关系如图甲所示。
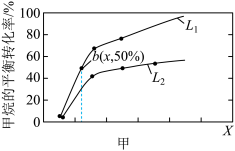
则 代表
代表___________ (填“温度”或“压强”):
___________  (填“大于”或“小于”),并请说出理由:
(填“大于”或“小于”),并请说出理由:___________ ; 点反应的平衡常数为
点反应的平衡常数为___________ 。
(4)500℃下,将 和
和 的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得
的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
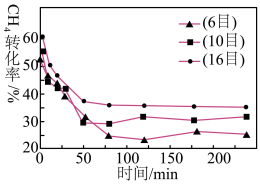
由图乙可知,75min后 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)①温度为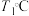 时,
时,
实验测得: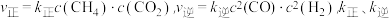 为速率常数。
为速率常数。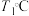 时,
时, =
=___________ (以 表示)。
表示)。
②当温度改变为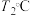 时,
时,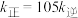 ,则
,则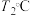 时平衡压强
时平衡压强___________ 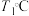 时平衡压强(填“>”“<”或“=”),理由是
时平衡压强(填“>”“<”或“=”),理由是___________ 。
 催化重整对温室气体的减排具有重要意义,其反应为
催化重整对温室气体的减排具有重要意义,其反应为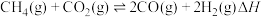 。回答下列问题:
。回答下列问题:(1)已知:①

②
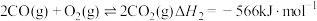
③
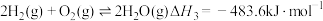
则

 。
。(2)恒容密闭容器中可逆反应
 达到平衡状态的标志是___________(填序号)。
达到平衡状态的标志是___________(填序号)。A.单位时间内生成1mol 的同时消耗2molCO 的同时消耗2molCO |
| B.混合气体的密度不再改变 |
C.反应速率 |
| D.混合气体的平均相对分子质量不再改变 |
 和
和 初始投料量分别为2mol和3mol,发生反应:
初始投料量分别为2mol和3mol,发生反应: ,甲烷的平衡转化率与温度、压强的关系如图甲所示。
,甲烷的平衡转化率与温度、压强的关系如图甲所示。
则
 代表
代表
 (填“大于”或“小于”),并请说出理由:
(填“大于”或“小于”),并请说出理由: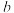 点反应的平衡常数为
点反应的平衡常数为(4)500℃下,将
 和
和 的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得
的混合气体(投料比为1:1)按一定流速通过盛有炭催化剂的反应器,测得 的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
的转化率受炭催化剂颗粒大小的影响如图乙所示(注:目数越大,表示炭催化剂颗粒越小)。
由图乙可知,75min后
 转化率与炭催化剂目数的关系为
转化率与炭催化剂目数的关系为(5)①温度为
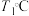 时,
时,
实验测得:
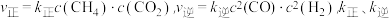 为速率常数。
为速率常数。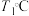 时,
时, =
= 表示)。
表示)。②当温度改变为
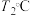 时,
时,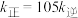 ,则
,则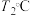 时平衡压强
时平衡压强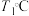 时平衡压强(填“>”“<”或“=”),理由是
时平衡压强(填“>”“<”或“=”),理由是
您最近一年使用:0次
2023-02-07更新
|
351次组卷
|
3卷引用:河南省洛阳市新安县第一高级中学2023届高三下学期入学检测化学试题



