解题方法
1 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
回答下列问题:
(1)①已知:CO(g)+2H2(g) CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为___________ 。
②一定条件下反应Ⅱ能自发进行原因是___________ 。
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为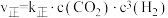 ,逆反应速率可表示为
,逆反应速率可表示为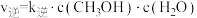 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。
①如图中能够代表k逆的曲线为___________ 。(填“L1”、“L2”、“L3”或“L4”)。
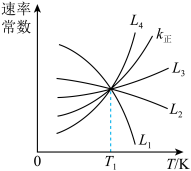
②温度为T1时,反应Ⅰ的化学平衡常数K=___________ 。
③对于上述反应体系,下列说法正确的是___________ 。
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。
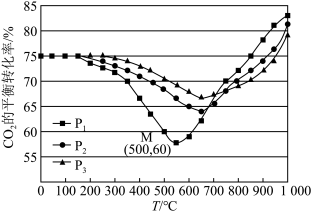
①压强P1、P2、P3由大到小的顺序是___________ ,在P1压强下,200℃~550℃时反应以___________ (填“Ⅰ”或“Ⅱ”)为主,原因是___________ 。
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因___________ 。
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1回答下列问题:
(1)①已知:CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为②一定条件下反应Ⅱ能自发进行原因是
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为
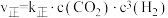 ,逆反应速率可表示为
,逆反应速率可表示为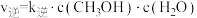 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。①如图中能够代表k逆的曲线为

②温度为T1时,反应Ⅰ的化学平衡常数K=
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。

①压强P1、P2、P3由大到小的顺序是
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因
您最近一年使用:0次
解题方法
2 . 尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
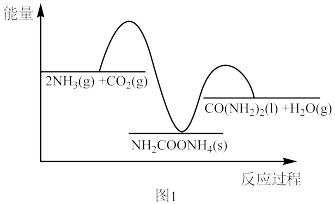
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
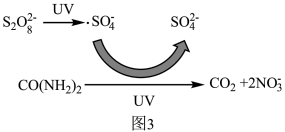
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
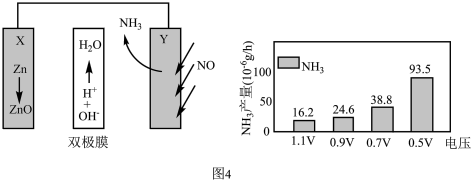
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
名校
解题方法
3 . 现代煤化工产生大量H2S废气,其回收利用有重要意义。
I.热解H2S制H2。
(1)已知下列反应的热化学方程式:
①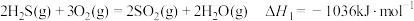
②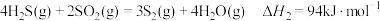
③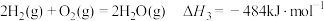
判断H2S热分解反应④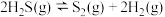 活化能
活化能
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)在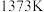 、
、 反应条件下,对于
反应条件下,对于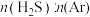 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的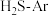 混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
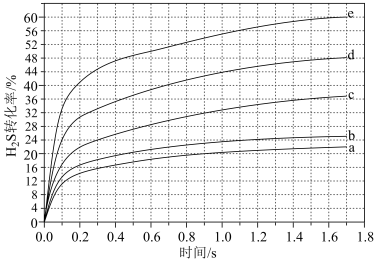
①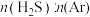 越大,H2S平衡转化率
越大,H2S平衡转化率_______ ,理由是_______ 。
②计算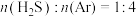 时,在
时,在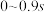 之间,H2S分压的平均变化率为
之间,H2S分压的平均变化率为_______  。
。
II.H2S可转化成羰基硫(COS):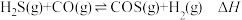 。
。
(3)绝热恒压条件下,密闭容器中充入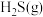 与
与 进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
(4)T℃下,将物质的量之比为2:1的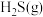 与
与 充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为
充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为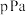 ,
,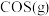 的体积分数为10%。则此时该反应的平衡常数
的体积分数为10%。则此时该反应的平衡常数
_______ (保留2位有效数字)。
III.用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为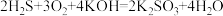
(5)电池的负极电极反应式为_______ 。
(6)若电池开始工作时每 电解质溶液含
电解质溶液含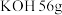 。取电池工作一段时间后的电解质溶液
。取电池工作一段时间后的电解质溶液 ,加入
,加入 溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为
溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为 ,计算电池工作的这段时间内至少通入了标况下的氧气约
,计算电池工作的这段时间内至少通入了标况下的氧气约_______ L。
I.热解H2S制H2。
(1)已知下列反应的热化学方程式:
①
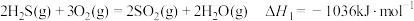
②
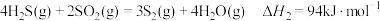
③
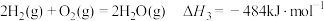
判断H2S热分解反应④
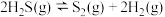 活化能
活化能
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)在
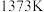 、
、 反应条件下,对于
反应条件下,对于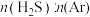 分别为4:1、1:1、1:4、1:9、1:19的
分别为4:1、1:1、1:4、1:9、1:19的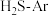 混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
①
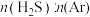 越大,H2S平衡转化率
越大,H2S平衡转化率②计算
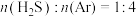 时,在
时,在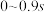 之间,H2S分压的平均变化率为
之间,H2S分压的平均变化率为 。
。II.H2S可转化成羰基硫(COS):
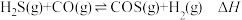 。
。(3)绝热恒压条件下,密闭容器中充入
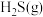 与
与 进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。
进行上述反应。下列事实不能说明反应达到平衡状态的是_______(填序号)。| A.混合气体的平均相对分子质量不再改变 |
B.生成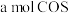 ,同时形成 ,同时形成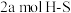 键 键 |
| C.化学平衡常数不再改变 |
| D.混合气体的密度不再改变 |
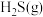 与
与 充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为
充入恒容密闭容器中进行上述反应,测得平衡时容器内气体的总压为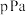 ,
,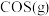 的体积分数为10%。则此时该反应的平衡常数
的体积分数为10%。则此时该反应的平衡常数
III.用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为
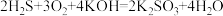
(5)电池的负极电极反应式为
(6)若电池开始工作时每
 电解质溶液含
电解质溶液含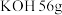 。取电池工作一段时间后的电解质溶液
。取电池工作一段时间后的电解质溶液 ,加入
,加入 溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为
溶液至沉淀完全,过滤洗涤沉淀,将沉淀在空气中充分加热至恒重,测得固体质量为 ,计算电池工作的这段时间内至少通入了标况下的氧气约
,计算电池工作的这段时间内至少通入了标况下的氧气约
您最近一年使用:0次
4 . “碳一化工”是指以含有一个碳原子的物质,如 等为原料合成化工产品的有机化工工艺。
等为原料合成化工产品的有机化工工艺。
(1)二氧化碳催化加氢制甲醇的总反应方程式可表示为: 。反应进程中体系能量的变化关系如图所示。其中
。反应进程中体系能量的变化关系如图所示。其中 ,
, 。
。

①总反应的
_______ 。
②该反应进程分两步进行。其中第_______ 步为慢反应。
③在不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率随温度的变化如图所示。压强
的平衡转化率随温度的变化如图所示。压强 由小到大的顺序为
由小到大的顺序为_______ 。温度T时,三条曲线几乎交于一点的原因是_______ 。

(2)利用电解可实现 和
和 的耦合转化。其原理如图所示。
的耦合转化。其原理如图所示。

①电极A与电源的_______ 相连。
②电极B上的反应式为_______ 。
(3)利用合成气(CO、H2)和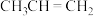 在高压(20~30MPa)条件下进行羰基合成,生成正丁醛(CH3CH2CH2CHO)的反应机理如图所示。
在高压(20~30MPa)条件下进行羰基合成,生成正丁醛(CH3CH2CH2CHO)的反应机理如图所示。

①反应的催化剂是_______ 。
②总反应的化学方程式为_______ 。
③已知反应体系中存在两个副反应: ;
; ,反应需要在高压条件下进行的原因可能是
,反应需要在高压条件下进行的原因可能是_______ 。
 等为原料合成化工产品的有机化工工艺。
等为原料合成化工产品的有机化工工艺。(1)二氧化碳催化加氢制甲醇的总反应方程式可表示为:
 。反应进程中体系能量的变化关系如图所示。其中
。反应进程中体系能量的变化关系如图所示。其中 ,
, 。
。
①总反应的

②该反应进程分两步进行。其中第
③在不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率随温度的变化如图所示。压强
的平衡转化率随温度的变化如图所示。压强 由小到大的顺序为
由小到大的顺序为
(2)利用电解可实现
 和
和 的耦合转化。其原理如图所示。
的耦合转化。其原理如图所示。
①电极A与电源的
②电极B上的反应式为
(3)利用合成气(CO、H2)和
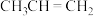 在高压(20~30MPa)条件下进行羰基合成,生成正丁醛(CH3CH2CH2CHO)的反应机理如图所示。
在高压(20~30MPa)条件下进行羰基合成,生成正丁醛(CH3CH2CH2CHO)的反应机理如图所示。
①反应的催化剂是
②总反应的化学方程式为
③已知反应体系中存在两个副反应:
 ;
; ,反应需要在高压条件下进行的原因可能是
,反应需要在高压条件下进行的原因可能是
您最近一年使用:0次
2022-04-29更新
|
251次组卷
|
3卷引用:江苏省徐州市第七中学2022-2023学年高二下学期4月调研化学试题



