1 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
(1)方法1:以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
第1步:2NH3(g)+CO2(g) NH2COONH4(s) ∆H1=-159.47kJ•mol-1
NH2COONH4(s) ∆H1=-159.47kJ•mol-1
第2步:……
①第2步反应的热化学反应方程式为_________ 。
②一定条件下的恒容容器中,充入1.5molNH3和1molCO2,平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)=_______ ,已知第2步反应的Kp=mkPa,测得平衡时容器内总压为3mkPa,则反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=________ 。
③若要提高NH3平衡转化率,可采取的措施有_______ (任写一条)。
(2)方法2:电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:
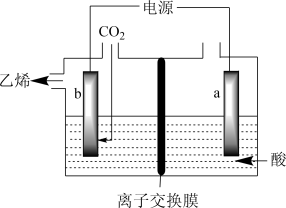
阴极电极反应式为________ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
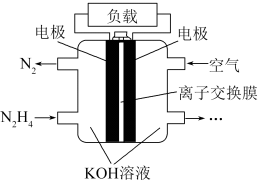
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为________ ,正极反应式为________ 。
(1)方法1:以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。第1步:2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1=-159.47kJ•mol-1
NH2COONH4(s) ∆H1=-159.47kJ•mol-1第2步:……
①第2步反应的热化学反应方程式为
②一定条件下的恒容容器中,充入1.5molNH3和1molCO2,平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)=
 CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=③若要提高NH3平衡转化率,可采取的措施有
(2)方法2:电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:

阴极电极反应式为
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

您最近一年使用:0次
名校
2 . I.依据题中所给信息完成指定问题:
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83kJ•mol-1
Cl2(g) ΔH1=+83kJ•mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ•mol-1
Cl2(g) ΔH2=-20kJ•mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ•mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=________ kJ•mol-1。
(2)用50mL0.50mol•L-1盐酸和50mL0.55mol•L-1NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4℃,反应后溶液的比热容为4.2J•g-1•℃-1,盐酸和NaOH溶液的密度都近似认为是1g•cm-3,则中和热ΔH=________ 。
II.Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH=akJ•mol-1。按n(H2)/n(CO)=2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=akJ•mol-1。按n(H2)/n(CO)=2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
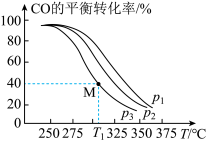
(3)该反应的ΔH________ (填“<”或“>”)0,图中p1、p2、p3由大到小的顺序是________ 。
(4)起始时,甲容器中c(H2)=0.20mol•L-1,c(CO)=0.10mol•L-1,在p3及T1℃下反应达到平衡,此时反应的平衡常数为________ 。起始时,乙容器中c(H2)=0.40mol•L-1,c(CO)=0.20mol•L-1,T1℃下反应达到平衡,CO的平衡转化率________ 。
A.大于40% B.小于40% C.等于40% D.等于80%
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83kJ•mol-1
Cl2(g) ΔH1=+83kJ•mol-1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ•mol-1
Cl2(g) ΔH2=-20kJ•mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121kJ•mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(2)用50mL0.50mol•L-1盐酸和50mL0.55mol•L-1NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4℃,反应后溶液的比热容为4.2J•g-1•℃-1,盐酸和NaOH溶液的密度都近似认为是1g•cm-3,则中和热ΔH=
II.Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH=akJ•mol-1。按n(H2)/n(CO)=2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=akJ•mol-1。按n(H2)/n(CO)=2将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。
(3)该反应的ΔH
(4)起始时,甲容器中c(H2)=0.20mol•L-1,c(CO)=0.10mol•L-1,在p3及T1℃下反应达到平衡,此时反应的平衡常数为
A.大于40% B.小于40% C.等于40% D.等于80%
您最近一年使用:0次
名校
解题方法
3 . 我国在第75届联合国大会上正式提出了2030年实现碳达峰、2060年实现碳中和的目标,所以研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的摩尔燃烧焓数据如表:
(1)则25℃时H2(g)和C(石墨,s)生成C2H2(l)的热化学方程式为________ 。
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一。
甲烷化主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-165kJ•mol-1
CH4(g)+2H2O(g) △H=-165kJ•mol-1
副反应:i.CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1=_______。
CH4(g)+H2O(g) ΔH1=_______。
ii.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ•mol-1;
CO(g)+H2O(g) △H2=+41.2kJ•mol-1;
iii.CO2(g)+2H2(g) C(s)+2H2O(g) △H3=-90kJ•mol-1;
C(s)+2H2O(g) △H3=-90kJ•mol-1;
iv.C(s)+H2O(g) CO(g)+H2(g) △H4=+131.3kJ•mol-1。
CO(g)+H2(g) △H4=+131.3kJ•mol-1。
(2)反应i的ΔH1=_______ ,该反应在_______ (填“高温”或“低温”)条件下能够自发进行反应。
(3)在恒温恒容的密闭容器中,关于反应iii叙述正确的是_______ 。
(4)某容器中加入一定量的CO2和H2,保持温度和压强不变的情况下,达平衡后再向该容器中注入Ar稀释,反应iii的化学平衡将_______ (填“正向移动”“逆向移动”或“不移动”),平衡时,CO2的分压p(CO2)_______ (填“增大”、“减小”或“不变”,下同)。
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应4H2(g)+CO2(g) CH4(g)+2H2O(g),不同温度下在相同时间测得CO2的转化率如图所示。
CH4(g)+2H2O(g),不同温度下在相同时间测得CO2的转化率如图所示。
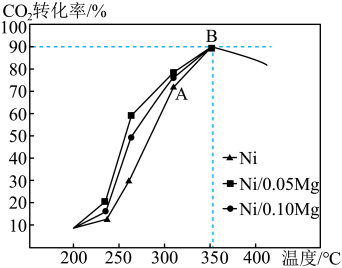
①B点的平衡常数KP=________ 。
②由图像可知,影响该催化剂活性的因素有________ 。
Ⅰ.化石燃料的燃烧产生大量的二氧化碳。已知25℃时,相关物质的摩尔燃烧焓数据如表:
| 物质 | H2(g) | C(石墨,s) | C2H2(l) |
| 摩尔燃烧焓ΔH(kJ•mol-1) | -285.8 | -393.5 | -1299.5 |
(1)则25℃时H2(g)和C(石墨,s)生成C2H2(l)的热化学方程式为
Ⅱ.二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一。
甲烷化主反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=-165kJ•mol-1
CH4(g)+2H2O(g) △H=-165kJ•mol-1副反应:i.CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1=_______。
CH4(g)+H2O(g) ΔH1=_______。ii.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ•mol-1;
CO(g)+H2O(g) △H2=+41.2kJ•mol-1;iii.CO2(g)+2H2(g)
 C(s)+2H2O(g) △H3=-90kJ•mol-1;
C(s)+2H2O(g) △H3=-90kJ•mol-1;iv.C(s)+H2O(g)
 CO(g)+H2(g) △H4=+131.3kJ•mol-1。
CO(g)+H2(g) △H4=+131.3kJ•mol-1。(2)反应i的ΔH1=
(3)在恒温恒容的密闭容器中,关于反应iii叙述正确的是
| A.用CO2、H2、H2O表示的速率之比为1:2:2可以作为判断化学平衡的依据 |
| B.容器中气体的压强不变时,不能作为平衡的判断依据 |
| C.容器内的气体密度不变可以作为平衡的判断依据 |
| D.使用催化剂不能改变平衡转化率 |
(4)某容器中加入一定量的CO2和H2,保持温度和压强不变的情况下,达平衡后再向该容器中注入Ar稀释,反应iii的化学平衡将
(5)以4molH2和1molCO2为初始原料,在催化剂(Ni/xMg)作用下保持总压为P0时,若只发生反应4H2(g)+CO2(g)
 CH4(g)+2H2O(g),不同温度下在相同时间测得CO2的转化率如图所示。
CH4(g)+2H2O(g),不同温度下在相同时间测得CO2的转化率如图所示。
①B点的平衡常数KP=
②由图像可知,影响该催化剂活性的因素有
您最近一年使用:0次
名校
4 . 溴代烷的制备,常规工艺分“氧化”和“溴化”两个过程,通常以 在合适温度下催化氧化
在合适温度下催化氧化 制备
制备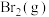 (溴易液化,注意控制温度和压强)。再利用
(溴易液化,注意控制温度和压强)。再利用 完成溴代过程来制备:新工艺是将烷烃、
完成溴代过程来制备:新工艺是将烷烃、 和
和 混合,直按催化“氧化溴化”得到溴代烷。回答下列问题:
混合,直按催化“氧化溴化”得到溴代烷。回答下列问题:
(1)已知:TK时,部分物质的相对能量如下表:
此温度下,在恒容密闭容器中充入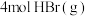 和
和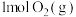 发生“氧化”,测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时测得放出热量为
发生“氧化”,测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时测得放出热量为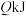 ,则下列关系正确的是___________(填标号)。
,则下列关系正确的是___________(填标号)。
(2)“溴化”时容器体积可变,在温度为TK时,向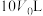 容器中投入初始浓度均为
容器中投入初始浓度均为 的
的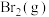 和
和 ,发生反应:
,发生反应: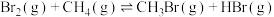 。保持温度不变,压缩容器体积,测得不同容积下
。保持温度不变,压缩容器体积,测得不同容积下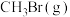 的平衡浓度如下表:
的平衡浓度如下表:
当容器体积从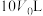 缩小到
缩小到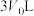 时,测得此时容器内仅有四种气态组分,平衡
时,测得此时容器内仅有四种气态组分,平衡___________ 移动(填“正向”“逆向”或“不”),m=___________ ;容器体积缩小到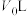 时,平衡
时,平衡___________ 移动(填“正向”“逆向”或“不”)。
(3)新工艺中,“氧化溴化“反应: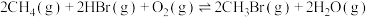
 ,反应起始物料
,反应起始物料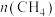 、
、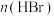 、
、 分别为
分别为 、
、 、
、 时,在不同条件下达到平衡,设体系中
时,在不同条件下达到平衡,设体系中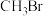 的物质的量分数为
的物质的量分数为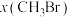 ,在T为
,在T为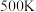 下的
下的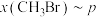 、在p为
、在p为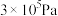 下的
下的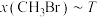 如图所示。a点对应的压强为
如图所示。a点对应的压强为___________ ;b点对应的反应条件为___________ ,此时
___________ (保留三位有效数字)。
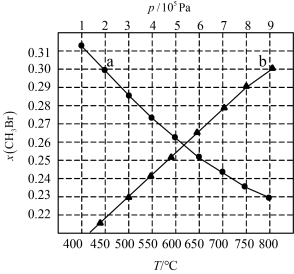
 在合适温度下催化氧化
在合适温度下催化氧化 制备
制备 (溴易液化,注意控制温度和压强)。再利用
(溴易液化,注意控制温度和压强)。再利用 完成溴代过程来制备:新工艺是将烷烃、
完成溴代过程来制备:新工艺是将烷烃、 和
和 混合,直按催化“氧化溴化”得到溴代烷。回答下列问题:
混合,直按催化“氧化溴化”得到溴代烷。回答下列问题:(1)已知:TK时,部分物质的相对能量如下表:
| 物质 |  | 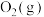 |  | 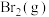 |
相对能量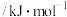 | x | y | z | w |
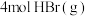 和
和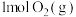 发生“氧化”,测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时测得放出热量为
发生“氧化”,测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时测得放出热量为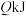 ,则下列关系正确的是___________(填标号)。
,则下列关系正确的是___________(填标号)。A.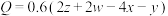 | B. |
C.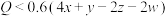 | D. |
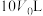 容器中投入初始浓度均为
容器中投入初始浓度均为 的
的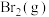 和
和 ,发生反应:
,发生反应: 。保持温度不变,压缩容器体积,测得不同容积下
。保持温度不变,压缩容器体积,测得不同容积下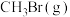 的平衡浓度如下表:
的平衡浓度如下表:容器体积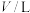 |  |  | 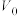 |
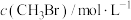 | m | 0.09 | 0.25 |
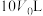 缩小到
缩小到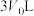 时,测得此时容器内仅有四种气态组分,平衡
时,测得此时容器内仅有四种气态组分,平衡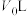 时,平衡
时,平衡(3)新工艺中,“氧化溴化“反应:
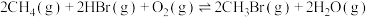
 ,反应起始物料
,反应起始物料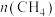 、
、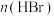 、
、 分别为
分别为 、
、 、
、 时,在不同条件下达到平衡,设体系中
时,在不同条件下达到平衡,设体系中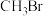 的物质的量分数为
的物质的量分数为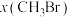 ,在T为
,在T为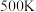 下的
下的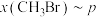 、在p为
、在p为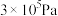 下的
下的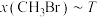 如图所示。a点对应的压强为
如图所示。a点对应的压强为

您最近一年使用:0次
名校
5 . 聚丙烯塑料是制造口罩的主要材料,丙烯是合成聚丙烯的原料。近日,科学家开发出自柱式纳米片( 稳定的高分散Pt)催化剂,用于高效催化丙烷脱氢。
稳定的高分散Pt)催化剂,用于高效催化丙烷脱氢。

(1)已知:几种共价键的键能数据如下:
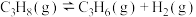
 。丙烯中
。丙烯中 键键能为
键键能为___________  。
。
(2)在恒温恒容密闭容器中充入 和3molAr(不参与反应),发生上述反应,下列叙述正确的是___________(填标号)。
和3molAr(不参与反应),发生上述反应,下列叙述正确的是___________(填标号)。
(3)已知:丙烷在一定温度下会发生副反应: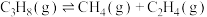 ,
,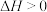 。丙烷的转化率和丙烯的选择性(选择性
。丙烷的转化率和丙烯的选择性(选择性 )随温度的变化如图甲所示。随着温度升高,丙烯的选择性降低的可能原因有
)随温度的变化如图甲所示。随着温度升高,丙烯的选择性降低的可能原因有___________ 。丙烷转化率增大的原因是___________ 。

(4)在T℃,压强恒定为116kPa时,向有催化剂的密闭容器中充入 和Ar,只发生脱氢反应。丙烷的平衡转化率与投料比
和Ar,只发生脱氢反应。丙烷的平衡转化率与投料比 关系如图乙所示。反应经过10min达到M点。
关系如图乙所示。反应经过10min达到M点。
①0~10min内丙烷的分压变化率为___________ 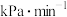 。
。
②该温度下,平衡常数 为
为___________ (要求带单位)。(注:用分压计算的平衡常数叫压强平衡常数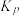 ,分压等于总压
,分压等于总压 物质的量分数)。
物质的量分数)。
(5)用惰性电极电解 的酸性溶液也可得丙烯
的酸性溶液也可得丙烯 ,其原理如图丙所示。则b极的电极反应式为
,其原理如图丙所示。则b极的电极反应式为___________ 。

 稳定的高分散Pt)催化剂,用于高效催化丙烷脱氢。
稳定的高分散Pt)催化剂,用于高效催化丙烷脱氢。
(1)已知:几种共价键的键能数据如下:
| 化学键 |  |  |  |  |
键能/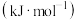 | 436 | 413 | a | b |
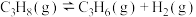
 。丙烯中
。丙烯中 键键能为
键键能为 。
。(2)在恒温恒容密闭容器中充入
 和3molAr(不参与反应),发生上述反应,下列叙述正确的是___________(填标号)。
和3molAr(不参与反应),发生上述反应,下列叙述正确的是___________(填标号)。| A.气体总压强不变时达到平衡状态 |
B.平衡时 体积分数为20% 体积分数为20% |
| C.加入催化剂能提高丙烷的平衡转化率 |
D.平衡后,充入少量 ,丙烷平衡转化率增大 ,丙烷平衡转化率增大 |
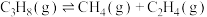 ,
,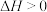 。丙烷的转化率和丙烯的选择性(选择性
。丙烷的转化率和丙烯的选择性(选择性 )随温度的变化如图甲所示。随着温度升高,丙烯的选择性降低的可能原因有
)随温度的变化如图甲所示。随着温度升高,丙烯的选择性降低的可能原因有
(4)在T℃,压强恒定为116kPa时,向有催化剂的密闭容器中充入
 和Ar,只发生脱氢反应。丙烷的平衡转化率与投料比
和Ar,只发生脱氢反应。丙烷的平衡转化率与投料比 关系如图乙所示。反应经过10min达到M点。
关系如图乙所示。反应经过10min达到M点。①0~10min内丙烷的分压变化率为
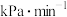 。
。②该温度下,平衡常数
 为
为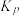 ,分压等于总压
,分压等于总压 物质的量分数)。
物质的量分数)。(5)用惰性电极电解
 的酸性溶液也可得丙烯
的酸性溶液也可得丙烯 ,其原理如图丙所示。则b极的电极反应式为
,其原理如图丙所示。则b极的电极反应式为
您最近一年使用:0次
2023-04-09更新
|
310次组卷
|
2卷引用:山东省聊城市部分学校2022-2023学年高三下学期第三次学业质量联合检测化学试题
名校
解题方法
6 . 甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
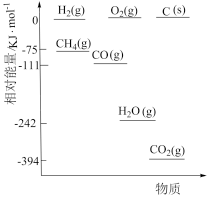
①相关物质相对能量大小如图所示,则△H1=_______ kJ·mol-1,升高温度,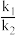
_______ (填“增大”或“减小”)。
②起始物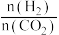 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______ vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______ Pa,反应I以物质的量分数表示的平衡常数KxI=_______ 。

(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
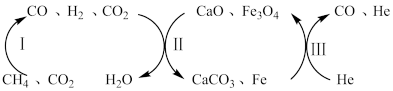
其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____ (填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______ (填“增大”、“减小”或“不变”),p(CO)_____ (填“增大”、“减小”或“不变”)。
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=
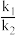

②起始物
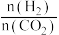 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。

其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将
您最近一年使用:0次
2023-03-19更新
|
952次组卷
|
3卷引用:山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
山东省烟台市、德州市、滨州市2023届高三一模考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(原理综合题)山东省日照实验高级中学2023-2024学年高二上学期第一次阶段考试化学试题
2023高三·全国·专题练习
解题方法
7 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
_______  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为_______ mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为_______ 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2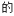 平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
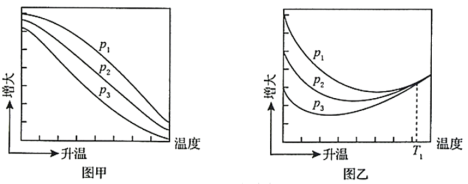
已知:CO2的平衡转化率=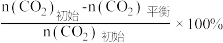
CH3OH的平衡产率=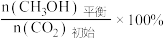
其中纵坐标表示CO2平衡转化率的是图_______ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为_______ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)

 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2
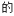 平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
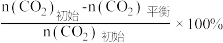
CH3OH的平衡产率=
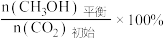
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近一年使用:0次
2023-01-31更新
|
546次组卷
|
4卷引用:山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)专题09 化学反应速率与化学平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)化学反应速率与化学平衡——课时5影响化学平衡的因素广东北江实验学校2023—2024学年高二上学期10月月考化学试题
名校
解题方法
8 . 氙的氟化物是优良的氟化剂,稀有气体Xe和F2混合在催化剂作用下同时存在如下反应:
反应I:
反应Ⅱ: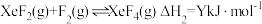
反应Ⅲ: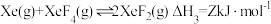
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
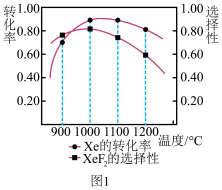
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为_______ ;当超过1000℃,XeF2选择性随着温度升高而降低的可能原因是_______ 。
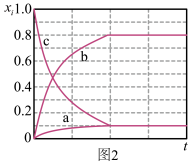
(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是_______ ,则反应过程能量变化为_______ kJ(用含X、Y的代数式表示),F2的转化率为_______ ,反应I以物质的量分数表示的平衡常数Kx=_______ 。
(3)在1000℃时,反应Ⅲ的平衡常数Kp=_______ ,保持初始其他条件不变,反应达平衡后增大体系压强,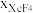 的变化趋势为
的变化趋势为_______ (填“增大”“减小”或“不变”)。
反应I:

反应Ⅱ:
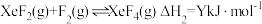
反应Ⅲ:
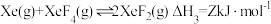
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为

(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是

(3)在1000℃时,反应Ⅲ的平衡常数Kp=
 的变化趋势为
的变化趋势为
您最近一年使用:0次
2023-01-15更新
|
530次组卷
|
3卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
山东省潍坊市2022-2023学年高三上学期期末考试化学试题(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题
2014·全国·一模
名校
解题方法
9 . 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________ 。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
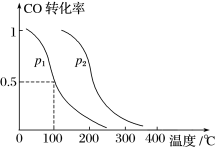
①p1________ p2(填“大于”、“小于”或“等于”);
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________ (填“增大”、“减小”或“不变”),平衡常数_____ (填“增大”、“减小”或“不变”)。
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________ (填“已经”或“没有”)达到平衡,此时刻υ正 ______ υ逆 (填“>”、“<”或“=”)。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。

①p1
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应
您最近一年使用:0次
2019-11-24更新
|
724次组卷
|
5卷引用:山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第一次质量检测化学试题



