名校
解题方法
1 . “碳达峰”“碳中和”是推动我国经济社会高质量发展的内在要求。通过二氧化碳催化加氢合成二甲醚是一种重要的转化方法,其过程如下:
反应Ⅰ:
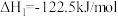
反应Ⅱ: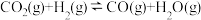
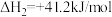
回答下列问题:
(1)二氧化碳与氢气合成CH3OCH3时,通常控制温度为 500℃左右,其可能的原因为_____(填字母)。
(2)在 1L 恒温密闭容器中充入4molCO2和6molH2 ,初始压强为 p,20min 时反应 Ⅰ、Ⅱ都达到平衡状态,体系压强为 0.8p,测得 c(H2O)=3mol/L。
①0~20min 内v(CO)=________ 。
②反应Ⅱ的化学平衡常数Kp=________ 。
③平衡时 CH3OCH3的选择性=________ 。( )
)
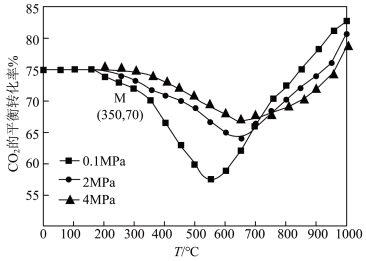
(3)在密闭容器中通入1 nolCO2和3molH2,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于 800℃时,随着压强的增大, CO2的平衡转化率减小,请解释原因:___________ 。
反应Ⅰ:

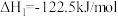
反应Ⅱ:
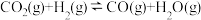
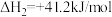
回答下列问题:
(1)二氧化碳与氢气合成CH3OCH3时,通常控制温度为 500℃左右,其可能的原因为_____(填字母)。
| A.反应速率快 | B.平衡的转化率高 |
| C.催化剂活性高 | D.主反应催化剂选择性好 |
(2)在 1L 恒温密闭容器中充入4molCO2和6molH2 ,初始压强为 p,20min 时反应 Ⅰ、Ⅱ都达到平衡状态,体系压强为 0.8p,测得 c(H2O)=3mol/L。
①0~20min 内v(CO)=
②反应Ⅱ的化学平衡常数Kp=
③平衡时 CH3OCH3的选择性=
 )
)(3)在密闭容器中通入1 nolCO2和3molH2,在铁系催化剂作用下进行反应, 的平衡转化率随温度和压强的变化如图所示。图中,温度大于 800℃时,随着压强的增大, CO2的平衡转化率减小,请解释原因:

您最近一年使用:0次
2 . 为实现生产生活的“碳减”和经济的可持续发展,科学工作者开展CO2的价值型转化的相关研究。请回答以下有关问题:
I.利用太阳能分解H2O获得氢气,再通过CO2加氢制甲醇(CH3OH)等燃料,从而实现可再生能源和CO2的资源化利用。

(1)过程Ⅱ中CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=+49.0 kJ∙mol−1
CH3OH(g)+H2O(g) △H1=+49.0 kJ∙mol−1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2 kJ∙mol−1
CO(g)+H2O(g) △H2=+41.2 kJ∙mol−1
①CO、H2、CH3OH的热化学方程式是_____ 。
②一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2(g)的浓度为_____ mol∙L−1 (用含a、b、V的代数式表示)。
③为提高CH3OH在单位时间的产率,可采取措施:_____ (写出一条即可)。
II.CO2催化加氢也可制取乙烯:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H=−129 kJ∙mol−1,在体积为2L的恒容容器中制取乙烯,投料为xmolCO2和3molH2,测得温度对CO2的平衡转化率的影响,曲线a表示x=1,改变投料比测量后得到曲线
C2H4(g)+4H2O(g) △H=−129 kJ∙mol−1,在体积为2L的恒容容器中制取乙烯,投料为xmolCO2和3molH2,测得温度对CO2的平衡转化率的影响,曲线a表示x=1,改变投料比测量后得到曲线 。
。
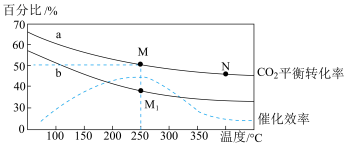
(2)曲线b条件下投料比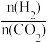 改变,则x
改变,则x_____ 1(填“>”、“<”或“=”);反应从开始分别进行到M、M1、N三点时,放出热量为Q1、Q2、Q3,其由大到小的顺序为______ 。
I.利用太阳能分解H2O获得氢气,再通过CO2加氢制甲醇(CH3OH)等燃料,从而实现可再生能源和CO2的资源化利用。

(1)过程Ⅱ中CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=+49.0 kJ∙mol−1
CH3OH(g)+H2O(g) △H1=+49.0 kJ∙mol−1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2 kJ∙mol−1
CO(g)+H2O(g) △H2=+41.2 kJ∙mol−1①CO、H2、CH3OH的热化学方程式是
②一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2(g)的浓度为
③为提高CH3OH在单位时间的产率,可采取措施:
II.CO2催化加氢也可制取乙烯:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H=−129 kJ∙mol−1,在体积为2L的恒容容器中制取乙烯,投料为xmolCO2和3molH2,测得温度对CO2的平衡转化率的影响,曲线a表示x=1,改变投料比测量后得到曲线
C2H4(g)+4H2O(g) △H=−129 kJ∙mol−1,在体积为2L的恒容容器中制取乙烯,投料为xmolCO2和3molH2,测得温度对CO2的平衡转化率的影响,曲线a表示x=1,改变投料比测量后得到曲线 。
。
(2)曲线b条件下投料比
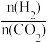 改变,则x
改变,则x
您最近一年使用:0次
名校
3 . Ⅰ.一定条件下,在容积为5 L的密闭容器中,A、B、C三种气体的物质的量随时间t的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
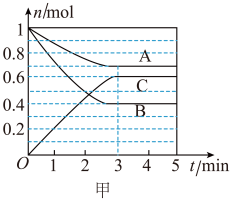
(1)该反应的化学方程式为_______ 。
(2)该反应的反应速率v随时间t的关系如图乙所示。
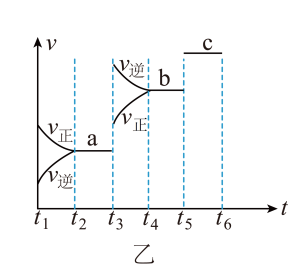
①根据图乙判断,在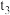 时刻改变的外界条件是
时刻改变的外界条件是_______ 。
②a、b、c对应的平衡状态中,C的体积分数最大的是状态_______ 。
③各阶段的平衡常数如表所示:
 、
、 、
、 之间的大小关系为
之间的大小关系为_______ (用“>”“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的 ,发生反应:
,发生反应: ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
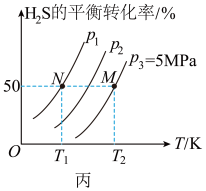
(3)
_______ (填填“>”“<”或“=”)0。
(4)图丙中压强( 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为_______ 。
(5)如果想进一步提高 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有_______ 。

(1)该反应的化学方程式为
(2)该反应的反应速率v随时间t的关系如图乙所示。

①根据图乙判断,在
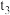 时刻改变的外界条件是
时刻改变的外界条件是②a、b、c对应的平衡状态中,C的体积分数最大的是状态
③各阶段的平衡常数如表所示:
 | 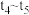 | 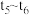 |
 |  |  |
 、
、 、
、 之间的大小关系为
之间的大小关系为Ⅱ.在密闭容器中充入一定量的
 ,发生反应:
,发生反应: ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)

(4)图丙中压强(
 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为(5)如果想进一步提高
 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
2022-07-20更新
|
203次组卷
|
2卷引用:陕西省西安中学2023-2024学年高二上学期第一次综合评价化学试题



