1 . 氨基甲酸铵发生分解的化学方程式为NH2COONH4(s) 2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1
(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0kPa、17.1kPa。下列说法错误的是
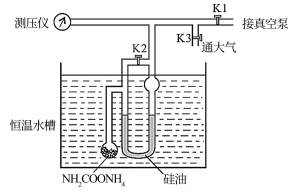
 2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1
(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0kPa、17.1kPa。下列说法错误的是

| A.若保持温度和容器体积不变,平衡后再充入n(NH3):n(CO2)=2:1,再次达到平衡时c(NH3)不变 |
| B.气体平均分子量不变不能作为判断反应达到平衡状态的依据 |
| C.该反应25℃时的化学平衡常数Kp=2.56×1011Pa3 |
| D.步骤Ⅱ中读数时U形管左侧液面偏低,Kp测量值偏大 |
您最近一年使用:0次
2 . 下列关于2SO2(g)+O2(g)⇌2SO3(g) ∆H=-197kJ∙mol-1的说法正确的是
| A.该反应的∆S>0 |
| B.该反应中,反应物的总能量小于生成物的总能量 |
| C.生产过程中将SO3分离出去,逆反应速率减慢 |
| D.其他条件不变,增大压强,平衡右移,平衡常数增大 |
您最近一年使用:0次
2021-12-14更新
|
531次组卷
|
5卷引用:江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题
江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省苏州市重点中学2022-2023学年高三上学期10月月考化学试题江苏省灌南高级中学2023-2024学年高三上学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期末考试化学试题
3 . 在体积可变的密闭容器中投入0.5 molO2和1 mol SO2,不同条件下发生反应:O2(g)+2SO2(g) 2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
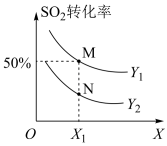
 2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
2SO3(g)ΔH。实验测得平衡时SO2的转化率[α(SO2 )]随温度、压强的变化如图所示。下列说法错误的是
| A.Y代表压强,且Y1> Y2;X代表温度,且ΔH <0 |
| B.M点反应物转化率之比α(O2) :α (SO2)=1:1,N点该比例减小 |
| C.若M、N两点对应的容器体积均为5 L,则N点的平衡常数K= 20 |
| D.M、N两点对应的平均摩尔质量:M(M)<M(N) |
您最近一年使用:0次
2021-12-03更新
|
229次组卷
|
2卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
4 . 利用合成气(主要成分为CO、CO2和H2)制备甲醇的主要反应有
①CO(g) +2H2(g) CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol
②CO2(g)+ H2(g) CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
①CO(g) +2H2(g)
 CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol②CO2(g)+ H2(g)
 CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
| A.增大CO2的浓度,有利于提高甲醇的产量 |
| B.升高温度,①和②反应速率都加快 |
| C.压缩体积,反应②平衡不移动 |
| D.平衡时c(CH3OH)为0.07 mol/L |
您最近一年使用:0次
2021-12-03更新
|
175次组卷
|
2卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
21-22高三上·江苏·期中
5 . N2O4与NO2能相互转化,N2O4易与水反应生成硝酸和亚硝酸混合物[25°C,Ka(HNO2)=4.6×10-4]。工业上制取四氧化二氮的方法是氨的催化氧化。下列有关说法正确的是
A.四氧化二氮与水反应的离子方程式为:N2O4+H2O=2H+ + + + |
B.恒温恒容条件下,2NO2(g) N2O4(g)平衡体系中再加入少量N2O4, N2O4(g)平衡体系中再加入少量N2O4,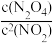 的值不变 的值不变 |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-904kJ·mol-1选用高效催化剂,可降低该反应的ΔH 4NO(g)+6H2O(g) △H=-904kJ·mol-1选用高效催化剂,可降低该反应的ΔH |
D.2NO2(g) N2O4(g),加压一定不能促进N2O4生成 N2O4(g),加压一定不能促进N2O4生成 |
您最近一年使用:0次
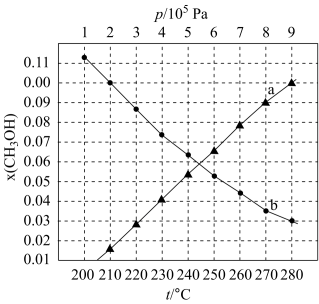
6 . 二氧化碳催化加氢制甲醇,合成反应可表示为:
 ,合成反应在起始物
,合成反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的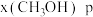 、在
、在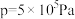 下的
下的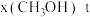 如图所示。下列说法
如图所示。下列说法不 正确的是

 ,合成反应在起始物
,合成反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的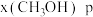 、在
、在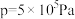 下的
下的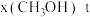 如图所示。下列说法
如图所示。下列说法
A. |
| B.图中对应等压过程的曲线是b |
C.当 时,反应条件可能为 时,反应条件可能为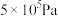 ,210℃或 ,210℃或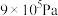 ,250℃ ,250℃ |
D. 、 、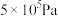 时,测得 时,测得 的平衡转化率为33.3%,则 的平衡转化率为33.3%,则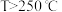 |
您最近一年使用:0次
7 . CO可用于合成甲醇,其反应的化学方程式为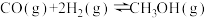 。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法
。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法不正确 的是
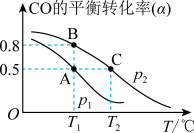
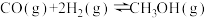 。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法
。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法
| A.合成甲醇的反应为放热反应 |
| B.压强为P1<P2 |
| C.A、B、C三点的平衡常数为KA=KB>KC |
| D.A点的v正和C点的v逆相等 |
您最近一年使用:0次
2021-11-12更新
|
163次组卷
|
3卷引用: 浙江省金华十校2021-2022学年高三上学期11月模拟考试化学试题
浙江省金华十校2021-2022学年高三上学期11月模拟考试化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
名校
解题方法
8 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
 N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。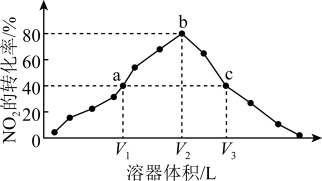
A.T℃时,该反应的化学平衡常数为Kc= mol·L-1 mol·L-1 |
| B.由图可知,c点V正>V逆 |
| C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡小 |
| D.容器内的压强:pa∶pb=6∶7 |
您最近一年使用:0次
2021-09-06更新
|
1449次组卷
|
16卷引用:重庆育才中学2022届高考适应性考试二化学试题
重庆育才中学2022届高考适应性考试二化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题山西省长治市第二中学2021-2022学年高三上学期第三次练考化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题河北省保定市定州市2021-2022学年高二上学期期中考试化学试题四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期期中考试化学试题广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题(已下线)化学(重庆A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)易错点4化学反应速率、平衡图像分析错误(已下线)题型24 化学反应平衡常数、平衡转化率图像福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
21-22高三上·江苏·阶段练习
名校
9 . 根据流程图,下列有关硝酸工业制备说法不正确 的是
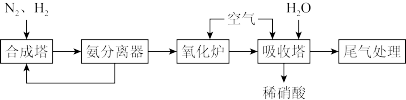

| A.合成塔中使用催化剂,可以提高单位时间内N2的转化率 |
| B.加压可以提高氧化炉中NH3的平衡转化率 |
| C.吸收塔中鼓入过量的空气可以提高硝酸的产率 |
| D.采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分 |
您最近一年使用:0次
名校
10 . 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列有关说法
4NO(g)+6H2O(g),下列有关说法不 正确的是
 4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列有关说法
4NO(g)+6H2O(g),下列有关说法| A.该反应一定能自发进行 |
| B.该反应的正反应的活化能小于逆反应的活化能 |
| C.断裂1mol N—H键的同时断裂1molO—H键,说明该反应达到平衡状态 |
| D.达到平衡时,增大容器的体积,v(正)增加、v(逆)减小 |
您最近一年使用:0次
2021-10-14更新
|
1423次组卷
|
8卷引用:江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题



