名校
1 . NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)ΔH=57kJ·mol-1,下列有关说法正确的是
| A.升高体系温度正反应速率增大,逆反应速率也增大 |
| B.若容器体积不变,气体密度不变时说明该反应建立化学平衡 |
C.其它条件不变,向平衡后的容器中再加入少量N2O4, 的值变大 的值变大 |
| D.增大体系的压强能提高N2O4的反应速率和转化率 |
您最近一年使用:0次
2 . 某化学反应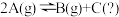 在三种不同条件下进行,
在三种不同条件下进行, 、
、 起始的物质的量为
起始的物质的量为 。反应物
。反应物 的浓度(
的浓度( )随反应时间的变化情况见下表,下列说法不正确的是
)随反应时间的变化情况见下表,下列说法不正确的是
 在三种不同条件下进行,
在三种不同条件下进行, 、
、 起始的物质的量为
起始的物质的量为 。反应物
。反应物 的浓度(
的浓度( )随反应时间的变化情况见下表,下列说法不正确的是
)随反应时间的变化情况见下表,下列说法不正确的是| 实验序号 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
 |  |
|
|
|
|
|
|
A.实验1中,前 中A的平均反应速率为 中A的平均反应速率为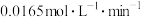 |
| B.实验1、2中,实验2可能使用了催化剂也可能压缩了体积 |
C.该反应的 |
D.实验3中,在 时加入一定量的C物质,平衡可能不移动 时加入一定量的C物质,平衡可能不移动 |
您最近一年使用:0次
3 . 在平衡体系: CaCO3(s) CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是

 CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
| A.该反应的平衡常数Kp=p (CO2) |
| B.容器体积缩小,CO2浓度增大,平衡向左移动 |
| C.t1时,CaO反应完全 |
| D.t1时,若再加入足量的CaO,达到新平衡时体系的压强大于P |
您最近一年使用:0次
名校
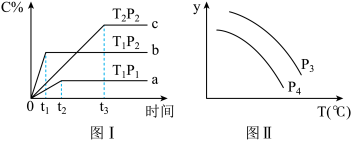
4 . 在某容积一定的密闭容器中,可逆反应:A(g)+B(g) xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)
 xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)
| A.p3>p4,y轴表示A的物质的量 |
| B.p3<p4,y轴表示C的体积分数 |
| C.p3<p4,y轴表示混合气体的密度 |
| D.p3>p4,y轴表示混合气体的平均相对分子质量 |
您最近一年使用:0次
2022-09-17更新
|
520次组卷
|
8卷引用:山西省吕梁市2020-2021学年高二上学期期末考试化学试题
5 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国提出争取2030年“碳达峰”,2060年“碳中和”。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为热点。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
则:反应Ⅱ的ΔH2=___________ kJ·mol-1
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是___________ ;
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是___________ 。
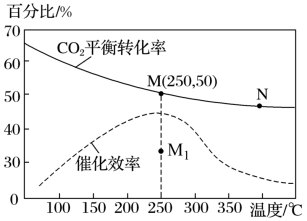
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=___________ L2/mol2,若要进一步提高甲醇的体积分数,可采取的措施有___________ (写一条即可)。
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I、2CO2+2e‑=C2O
II、C2O =CO2+CO
=CO2+CO
III、___________
IV、 +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为___________ 。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1则:反应Ⅱ的ΔH2=
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I、2CO2+2e‑=C2O

II、C2O
 =CO2+CO
=CO2+CO
III、
IV、
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
您最近一年使用:0次
名校
解题方法
6 . 通过下列反应合成CO和CH4,可实现CO2的再转化:
①CO2(g)+4H2(g) CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
②CO2(g)+H2(g) CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
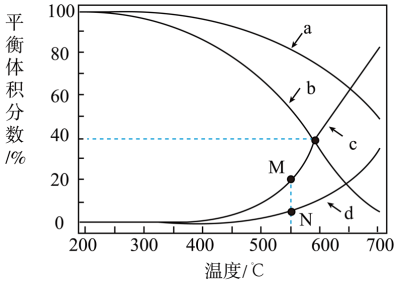
在密闭容器中通入3 mol的H2和1 mol的CO2,分别在压强为1 MPa 和10 MPa下进行反应。实验中对平衡体系的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4在三种物质中的体积分数影响如图所示。
下列说法不正确的是
①CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0②CO2(g)+H2(g)
 CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0在密闭容器中通入3 mol的H2和1 mol的CO2,分别在压强为1 MPa 和10 MPa下进行反应。实验中对平衡体系的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4在三种物质中的体积分数影响如图所示。

下列说法不正确的是
| A.曲线a表示10 MPa条件下CH4的体积分数随温度的变化 |
| B.曲线a、d交点纵坐标可能为40% |
| C.550°C时M点位于N点上方是由于压强降低时,平衡①逆向移动导致平衡②正向移动 |
| D.由曲线b、c的交点可计算该温度下反应②的平衡常数为2.4 |
您最近一年使用:0次
2022-09-02更新
|
215次组卷
|
2卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题
名校
7 . 在密闭容器中进行某可逆反应 , 在 t1 时刻降低温度或减小压强, 速率的变化均符合下图中的情况 ,则有关该反应的说法中不正确的是
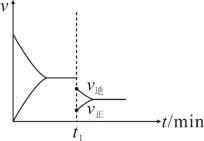

| A.由图判断△S小于0 |
| B.由图判断△H <0 |
| C.降低温时,达到新平衡时平衡常数增大 |
| D.降温或减压,平衡向逆反应方向移动 |
您最近一年使用:0次
8 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ⇌2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列见表,下列说法错误的是
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大 |
| B.当混合气体平均相对分子质量为26时说明该反应已达平衡 |
| C.根据表中数据,计算25.0 ℃时分解的浓度平衡常数约为1.6×10-8 mol3/L3 |
| D.若保持温度和容器体积不变,平衡后再充入n(NH3)∶n(CO2)=2∶1,则再次达到平衡时c(NH3)不变 |
您最近一年使用:0次
2021-04-07更新
|
440次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二下学期第一次月考化学(理)试题
名校
解题方法
9 . 正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
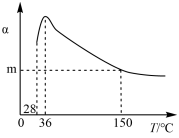
下列说法不正确 的是

名称 | 熔点/℃ | 沸点/℃ | 燃烧热 ∆H /kJ•mol-1 |
正戊烷 | -130 | 36 | –3506.1 |
异戊烷 | -159.4 | 27.8 | –3504.1 |
| A.25 ℃,101 kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:CH3CH2CH2CH2CH3(l) = (CH3)2CHCH2CH3(l) ∆H = –2.0 kJ/mol |
| B.28~36 ℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动 |
| C.36~150 ℃时,随温度升高,正戊烷异构化反应的平衡常数增大 |
| D.150 ℃时,体系压强从100 kPa升高到500 kPa,正戊烷的平衡转化率基本不变 |
您最近一年使用:0次
2021-04-05更新
|
1203次组卷
|
12卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(01)湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省汕头市金山中学2021届高三下学期第三次模拟考试化学试题重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题(已下线)第22讲 化学平衡常数及转化率的计算(精练)-2022年高考化学一轮复习讲练测天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题湖北省武汉市第一中学2023届高三上学期第一次月考化学试题北京市朝阳区2023届高三下学期三模化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题辽宁省沈阳市东北育才双语学校2023-2024学年高二上学期自主测评化学试题
名校
解题方法
10 . 一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应: S2Cl2(g)+Cl2(g) 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
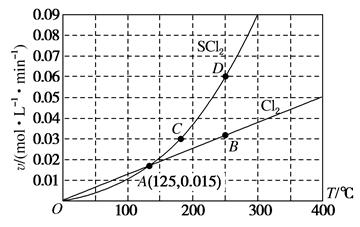
 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
| A.正反应的活化能大于逆反应的活化能 |
| B.A、B、C、D四点对应状态下,达到平衡状态的为A点 |
| C.一定温度下,在密闭容器中达到平衡后缩小容器体积,重新达到平衡后,S2Cl2的平衡转化率不变 |
| D.达到平衡后再加热,平衡向逆反应方向移动 |
您最近一年使用:0次
2021-03-29更新
|
326次组卷
|
3卷引用:山东省临沂第七中学2021届高三上学期期末考试化学试题