1 . CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为CO(g)+2H2(g)  CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
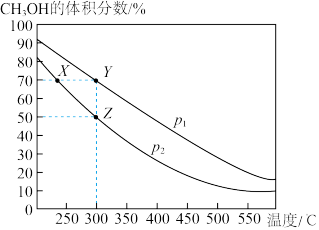
 CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
| A.p1<p2 | B.该反应的ΔH>0 |
| C.平衡常数:K(X)=K(Y) | D.在Z点时,CO转化率为75% |
您最近一年使用:0次
2022-04-11更新
|
349次组卷
|
23卷引用:福建省龙海第二中学2021届高三上学期第三次月考试题(1月)化学试题
福建省龙海第二中学2021届高三上学期第三次月考试题(1月)化学试题北京市通州区2021届高三一模化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷云南省民族大学附属中学2019届高三上学期期中考试化学试题内蒙古北方重工业集团有限公司第三中学2019-2020学年高二10月月考化学试题湖北省武汉市汉阳一中2019-2020学年高二9月月考化学试题人教版选修四2019-2020学年高二上学期期末复习化学综合训练福建省漳州市龙海市第二中学2020届高三上学期第二次月考化学试题甘肃省张掖市第二中学2020届高三上学期11月月考化学试题江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题河北省衡水中学2020届高三上学期第四次调研考试化学试题【省级联考】浙江省2019—2020学年普通高校招生选考科目化学模拟试题(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题河南省实验中学2020-2021学年高二上学期期中考试化学试题江西省景德镇一中2020-2021学年高二上学期期中考试化学(2班)试题四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题江西省南昌市第三中学2020~2021学年高二上学期期中考试化学试题山西省运城市芮城中学2021-2022学年高二上学期12月月考化学试题广东省汕头市金山中学2021-2022学年高二上学期期末考试化学试题广东省肇庆市第一中学2022-2023学年高二上学期期中考试化学试题湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
2 . 下列说法不正确的是
| A.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多 |
| B.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多 |
| C.升高温度,活化分子百分数增加,分子运动速度加快,有效碰撞次数增多 |
| D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多 |
您最近一年使用:0次
2021-12-24更新
|
534次组卷
|
22卷引用:山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题
山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡内蒙古集宁一中(西校区)2018-2019学年高一下学期期末考试化学试题河南省南阳一中2019-2020学年高二上期第二次月考化学试题【全国百强校】甘肃省静宁县第一中学2019-2020学年高二上学期第二次考试化学试题云南省迪庆州维西县第二中学2019-2020学年上学期高二期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题辽宁省阜新市第二高级中学2020-2021学年高二上学期第二次月考化学试题天津市红桥区2021-2022学年高二上学期期末考试化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题云南省昆明市第十中学2021-2022学年高二下学期3月月考化学试题浙江省玉环市玉城中学2022-2023学年高二上学期第一次月考化学试题 新疆维吾尔自治区喀什第六中学2022-2023学年高二上学期第一次月考化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题浙江省龙泉浙大中学2022-2023学年高二上学期12月教学质量检测化学试题新疆奎屯市第一高级中学2023-2024学年高二上学期9月月考化学试题广东省台山市某校2023-2024学年高二上学期期中考试化学试题
3 . 氨基甲酸铵发生分解的化学方程式为NH2COONH4(s) 2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1
(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0kPa、17.1kPa。下列说法错误的是
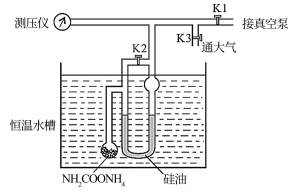
 2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g)+CO2(g)。利用如图装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1
(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0kPa、17.1kPa。下列说法错误的是

| A.若保持温度和容器体积不变,平衡后再充入n(NH3):n(CO2)=2:1,再次达到平衡时c(NH3)不变 |
| B.气体平均分子量不变不能作为判断反应达到平衡状态的依据 |
| C.该反应25℃时的化学平衡常数Kp=2.56×1011Pa3 |
| D.步骤Ⅱ中读数时U形管左侧液面偏低,Kp测量值偏大 |
您最近一年使用:0次
名校
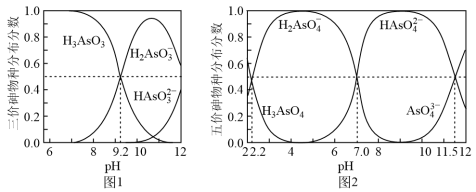
4 . 砷(As)是第四周期VA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途,回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。化学反应化学方程式为:2As2S3+5O2+6H2O=4H3AsO4+6S。该反应需要在加压下进行,原因是:___________
(2)298K时,将20mL3xmol/L Na3AsO3、20mL3xmol/LI2和20mL NaOH溶液混合,发生反应:AsO (aq)+I2(aq)+2OH-=AsO
(aq)+I2(aq)+2OH-=AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
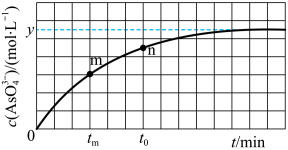
①下列可判断反应达到平衡状态的是___________ (填标号)
a.溶液的pH不再变化 b.v(I-)=2v(AsO )
)
c.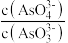 不再变化 d.c(I-)=ymol⋅L-1
不再变化 d.c(I-)=ymol⋅L-1
②tm时,v正___________ v逆(填“大于”“小于”成“等于”)
③若平衡时溶液的pH=14,则该反应的平衡常数K=___________ (用x、y代数式表示)
(3)常温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图−1和图−2所示。下列说法错误的是___________
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。化学反应化学方程式为:2As2S3+5O2+6H2O=4H3AsO4+6S。该反应需要在加压下进行,原因是:
(2)298K时,将20mL3xmol/L Na3AsO3、20mL3xmol/LI2和20mL NaOH溶液混合,发生反应:AsO
 (aq)+I2(aq)+2OH-=AsO
(aq)+I2(aq)+2OH-=AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡状态的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO
 )
)c.
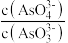 不再变化 d.c(I-)=ymol⋅L-1
不再变化 d.c(I-)=ymol⋅L-1②tm时,v正
③若平衡时溶液的pH=14,则该反应的平衡常数K=
(3)常温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图−1和图−2所示。下列说法错误的是___________

A.以酚酞为指示剂,将氢氧化钠溶液逐滴加入到亚砷酸H3AsO3溶液中,当溶液由无色变为浅红色时,主要反应的离子方程式为:OH-+H3AsO3=H2AsO +H2O +H2O |
| B.常温下,H3AsO4清液中Ka1:Ka2:Ka3=109.3:105.5:1 |
C.H3AsO4水溶液中存在:c(H+)=c(OH-)+c(H2AsO )+2c(HAsO )+2c(HAsO )+3c(AsO )+3c(AsO ) ) |
| D.H3AsO3和Na2HAsO4水溶液可发生复分解反应 |
您最近一年使用:0次
5 . 下列关于2SO2(g)+O2(g)⇌2SO3(g) ∆H=-197kJ∙mol-1的说法正确的是
| A.该反应的∆S>0 |
| B.该反应中,反应物的总能量小于生成物的总能量 |
| C.生产过程中将SO3分离出去,逆反应速率减慢 |
| D.其他条件不变,增大压强,平衡右移,平衡常数增大 |
您最近一年使用:0次
2021-12-14更新
|
531次组卷
|
5卷引用:江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题
江苏省南通市海门区2021-2022学年高三第二次诊断测试化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期末考试化学试题 江苏省苏州市重点中学2022-2023学年高三上学期10月月考化学试题江苏省灌南高级中学2023-2024学年高三上学期第一次月考化学试题
6 . 利用合成气(主要成分为CO、CO2和H2)制备甲醇的主要反应有
①CO(g) +2H2(g) CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol
②CO2(g)+ H2(g) CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
①CO(g) +2H2(g)
 CH3OH(g) ΔH1 =-116 kJ/mol
CH3OH(g) ΔH1 =-116 kJ/mol②CO2(g)+ H2(g)
 CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2 kJ/mol向一固定体积的容器中充入合成气,已知起始时c(CO)=0.1 mol/L、c(H2)=0.3 mol/L,平衡时c(CO)=0.05 mol/L,c(H2O)=0.02 mol/L,则下列说法错误的是
| A.增大CO2的浓度,有利于提高甲醇的产量 |
| B.升高温度,①和②反应速率都加快 |
| C.压缩体积,反应②平衡不移动 |
| D.平衡时c(CH3OH)为0.07 mol/L |
您最近一年使用:0次
2021-12-03更新
|
175次组卷
|
2卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
名校
解题方法
7 . 在容积一定的密闭容器中,可逆反应:A(g)+B(g) ⇌xC(g),符合图(I)所示关系,由此推断对图(II)的说法正确的是
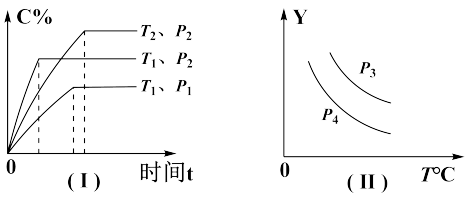
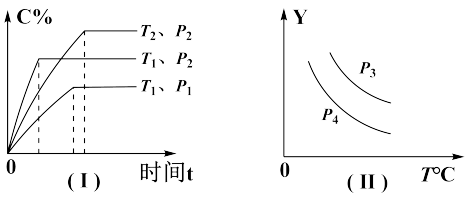
| A.P3<P4,Y轴表示混合气体平均摩尔质量 |
| B.P3<P4,Y轴表示C的质量分数 |
| C.P3>P4,Y轴表示A的转化率 |
| D.P3>P4,Y轴表示混合气体密度 |
您最近一年使用:0次
2021-12-02更新
|
380次组卷
|
4卷引用:江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题
江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题陕西省咸阳市实验中学2019-2020学年高二上学期第二次月考化学试题(已下线)专题24 化学平衡图像题的突破-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)黑龙江省哈尔滨市第九中学2022-2023学年高二上学期开学考试化学试题
名校
解题方法
8 . 已知甲醇是一种重要的工业原料,由甲醇脱氢可制取甲醛:CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在1L的密闭容器中进行)。下列有关说法正确的是
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在1L的密闭容器中进行)。下列有关说法正确的是

 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在1L的密闭容器中进行)。下列有关说法正确的是
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在1L的密闭容器中进行)。下列有关说法正确的是
| A.甲醇脱氢反应的ΔH<0 |
| B.600K时,Y点甲醇的v正<v逆 |
| C.从Y点到Z点可通过减小压强实现 |
| D.在T1条件下,该反应的平衡常数为8.1 |
您最近一年使用:0次
2021-10-21更新
|
163次组卷
|
2卷引用:浙江省台州市书生中学2021-2022学年高二10月份月考化学试题
9 . 一定温度下,某气态平衡体系的平衡常数表达式为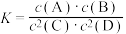 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是A.升高温度,平衡常数 一定增大 一定增大 | B.增大 浓度,平衡向正反应方向移动 浓度,平衡向正反应方向移动 |
C.增大压强, 体积分数增加 体积分数增加 | D.升高温度,若 的百分含量减少,则正反应是放热反应 的百分含量减少,则正反应是放热反应 |
您最近一年使用:0次
2021-10-15更新
|
134次组卷
|
3卷引用:山东省烟台市招远市第二中学2021-2022学年高二10月月考化学试题
山东省烟台市招远市第二中学2021-2022学年高二10月月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题
名校
10 . 在三个相同容器中各充入1molN2和3molH2,在不同条件下反应达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是
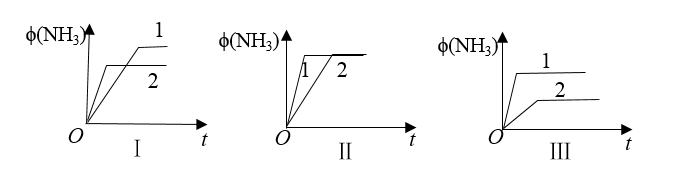

| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1 |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2 |
您最近一年使用:0次



