解题方法
1 . 醛酮在酸或碱的催化下生成偕二醇的反应历程如下:
下列说法不正确的是
酸催化历程: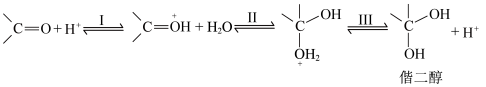
碱催化历程: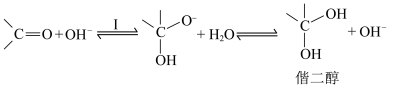
| 羰基化合物 |  |  |  |
| 平衡常数K | 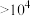 | 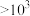 |  |
A.酸催化历程的步骤I中 与羰基中的O结合,增大了碳氧双键的极性 与羰基中的O结合,增大了碳氧双键的极性 |
B.对比酸和碱的催化历程可知,与羰基反应的活性: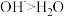 |
C.无论酸或碱催化,生成偕二醇的平衡常数: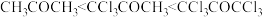 |
D.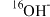 催化下, 催化下,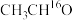 的 的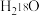 溶液中无法生成 溶液中无法生成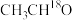 |
您最近一年使用:0次
名校
解题方法
2 . 反应 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
A. 位于元素周期表 位于元素周期表 区 区 |
B.反应过程中, 参与反应,降低了反应的焓变 参与反应,降低了反应的焓变 |
C.该反应的平衡常数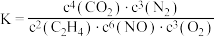 |
D.其他条件不变时,增大 , ,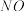 的平衡转化率下降 的平衡转化率下降 |
您最近一年使用:0次
名校
3 . 向碘水中加入KI溶液,发生反应: ,充分反应达平衡后,测得微粒浓度如下:
,充分反应达平衡后,测得微粒浓度如下:
下列说法不正确 的是
 ,充分反应达平衡后,测得微粒浓度如下:
,充分反应达平衡后,测得微粒浓度如下:| 微粒 |  |  |  |
浓度/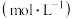 | 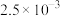 | 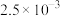 |  |
A.配制碘水时,加入少量KI,可促进 的溶解 的溶解 |
B.该温度下,反应 的 的 |
C.向所得溶液中加入 ,振荡静置,水层 ,振荡静置,水层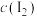 降低 降低 |
D.向所得溶液中加入等体积水,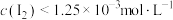 |
您最近一年使用:0次
2024-02-13更新
|
155次组卷
|
2卷引用:北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
4 . 环境保护与绿色发展是新时代人们关心的共同话题。NO是大气主要污染物,因此对工业烟气脱硝是工业生产中的重要一环。煤燃烧排放的烟气含有NO,脱除的方法有多种。
(1)目前常见方法是采用 溶液液相氧化法脱除烟气中的NO,其主要过程如下:
溶液液相氧化法脱除烟气中的NO,其主要过程如下:
Ⅰ.
Ⅱ.
①NO(aq)转化为HNO3(aq)的热化学方程式___________ 。
②为提高NO脱除率,工业上常向NaClO溶液中加入稀硫酸调节 ,溶液初始
,溶液初始 与NO的脱除率如下表所示。
与NO的脱除率如下表所示。
 影响NO脱除率的原因是
影响NO脱除率的原因是___________ 。
(2)理论上可采用加热使NO分解的方法处理: 。
。
①该反应的平衡常数表达式为___________ ;
②已知该反应的正反应活化能为 ,逆反应的活化能为
,逆反应的活化能为 ;正反应熵变为
;正反应熵变为 。实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因
。实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因___________ 。
(3)近期科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C-OH,其电离平衡可表示为 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化:
预氧化:
预氧化:
吸附:
NO吸附实验在25℃下进行,将一定比例的 与NO混合气体在
与NO混合气体在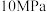 恒压下,以相同速率
恒压下,以相同速率持续 通入到等量的、不同预氧化试剂处理的活性炭中(图像中“原始-C”表示未经处理的活性炭),获得“NO捕获率-通气时间”的变化图:

已知: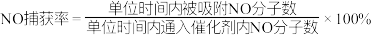
①下列描述正确的是___________ 。
A.25℃下原始-C在通气约175分钟后吸附效果超过了
B.若其他条件不变,增大混合气体中 物质的量分数,吸附平衡会正向移动
物质的量分数,吸附平衡会正向移动
C. 在实验中吸附效果不佳,可能是活性炭表面孔隙被
在实验中吸附效果不佳,可能是活性炭表面孔隙被 堵塞
堵塞
D.升高温度,等量活性炭催化剂吸附的NO分子总数会减少
②相比其他预氧化试剂处理的活性炭, 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释___________ 。
(1)目前常见方法是采用
 溶液液相氧化法脱除烟气中的NO,其主要过程如下:
溶液液相氧化法脱除烟气中的NO,其主要过程如下:Ⅰ.

Ⅱ.

①NO(aq)转化为HNO3(aq)的热化学方程式
②为提高NO脱除率,工业上常向NaClO溶液中加入稀硫酸调节
 ,溶液初始
,溶液初始 与NO的脱除率如下表所示。
与NO的脱除率如下表所示。初始 | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
| NO脱除率 | 91% | 88% | 83% | 65% | 51% |
 影响NO脱除率的原因是
影响NO脱除率的原因是(2)理论上可采用加热使NO分解的方法处理:
 。
。①该反应的平衡常数表达式为
②已知该反应的正反应活化能为
 ,逆反应的活化能为
,逆反应的活化能为 ;正反应熵变为
;正反应熵变为 。实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因
。实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因(3)近期科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C-OH,其电离平衡可表示为
 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:

预氧化:

预氧化:

吸附:

NO吸附实验在25℃下进行,将一定比例的
 与NO混合气体在
与NO混合气体在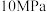 恒压下,以相同速率
恒压下,以相同速率
已知:
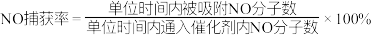
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了

B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会正向移动
物质的量分数,吸附平衡会正向移动C.
 在实验中吸附效果不佳,可能是活性炭表面孔隙被
在实验中吸附效果不佳,可能是活性炭表面孔隙被 堵塞
堵塞D.升高温度,等量活性炭催化剂吸附的NO分子总数会减少
②相比其他预氧化试剂处理的活性炭,
 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
5 . 在某一恒容密闭容器中,发生反应 ,下列有关该反应的说法正确的是
,下列有关该反应的说法正确的是
 ,下列有关该反应的说法正确的是
,下列有关该反应的说法正确的是A.该反应的平衡常数表达式为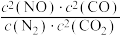 |
| B.当混合气体的密度不再随时间改变时,该反应达到平衡 |
C.反应达到平衡后,该容器中一定同时存在NO和 |
| D.适当升高温度,正反应速率加快,逆反应速率减慢 |
您最近一年使用:0次
6 . 羰基硫(COS),用于合成除草剂、杀虫剂等,还能作粮食熏蒸剂。 、分别与
、分别与 反应均能制得
反应均能制得 ,反应如下:
,反应如下:
反应I: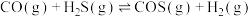

反应Ⅱ: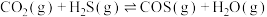

已知:在相同条件下,向两个容积相同且不变的密闭容器中按下表投料 不参与反应),分别发生上述反应。温度相同时,反应I的平衡常数大于反应Ⅱ的平衡常数。实线
不参与反应),分别发生上述反应。温度相同时,反应I的平衡常数大于反应Ⅱ的平衡常数。实线 表示在相同的时间内两反应中
表示在相同的时间内两反应中 随温度的变化关系如下图所示;虚线
随温度的变化关系如下图所示;虚线 表示两反应的平衡曲线。
表示两反应的平衡曲线。
(1)下列可判断反应Ⅱ达到平衡的是_____。
(2)实验测得反应Ⅱ的速率方程为: ,k为速率常数,则达到平衡后,仅升高温度k正增大的倍数
,k为速率常数,则达到平衡后,仅升高温度k正增大的倍数_____ (填“>”、“<”或“=”)k逆增大的倍数。
(3)上图中能表示反应I的曲线是_____ ;相同条件下,延长足够的反应时间,反应体系中 点
点 的物质的量达到
的物质的量达到_____ 点(填“X”或“W”),该温度下该反应的平衡常数为_____ 。
 、分别与
、分别与 反应均能制得
反应均能制得 ,反应如下:
,反应如下:反应I:
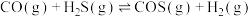

反应Ⅱ:
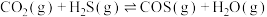

已知:在相同条件下,向两个容积相同且不变的密闭容器中按下表投料
 不参与反应),分别发生上述反应。温度相同时,反应I的平衡常数大于反应Ⅱ的平衡常数。实线
不参与反应),分别发生上述反应。温度相同时,反应I的平衡常数大于反应Ⅱ的平衡常数。实线 表示在相同的时间内两反应中
表示在相同的时间内两反应中 随温度的变化关系如下图所示;虚线
随温度的变化关系如下图所示;虚线 表示两反应的平衡曲线。
表示两反应的平衡曲线。| 反应I | 反应Ⅱ | |||||
| 起始投料 |  |  |  |  |  |  |
起始物质的量 | 1 | 1 | 3 | 1 | 1 | 3 |

(1)下列可判断反应Ⅱ达到平衡的是_____。
| A.V正(H2S)=V正(COS) | B.容器内压强不再变化 |
C. 不再变化 不再变化 | D. |
(2)实验测得反应Ⅱ的速率方程为:
 ,k为速率常数,则达到平衡后,仅升高温度k正增大的倍数
,k为速率常数,则达到平衡后,仅升高温度k正增大的倍数(3)上图中能表示反应I的曲线是
 点
点 的物质的量达到
的物质的量达到
您最近一年使用:0次
2023-12-06更新
|
65次组卷
|
2卷引用:山东省临沂市临沭第一中学2023-2024学年高二上学期12月月考化学试题
解题方法
7 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密团容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据表中数据分析T1℃时,该反应在0-10 min内的平均反应速率v(NO)=_______ ;写出此反应的化学平衡常数表达式K=_______ 。
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率_______ (填“升高”或“降低”)。
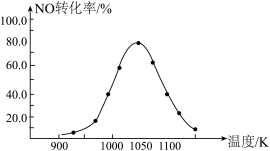
③在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率α(NO)随温度的变化如图所示。由图可知,1050K 前反应中NO的转化率随温度升高面增大,原因是_______ 。
(2)以连二硫酸根(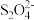 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
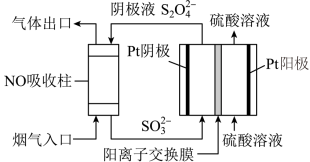
①阴极区的电极反应式为_______ 。
②NO吸收转化后的主要产物为NH3,若通电时电路中转移了1.0mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______ L。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密团容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.80 | 0.80 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 |
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
③在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率α(NO)随温度的变化如图所示。由图可知,1050K 前反应中NO的转化率随温度升高面增大,原因是

(2)以连二硫酸根(
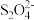 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH3,若通电时电路中转移了1.0mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
8 . I.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________ 。
(2)在实际生产中,选定的温度为400~500℃,原因是________ 。
(3)在实际生产中,采用的压强为常压,原因是________ 。
(4)在实际生产中,通入过量的空气,原因是________ 。
(5)尾气中SO2必须回收,原因是________ 。
II.Bodenstein研究了反应:2HI(g) H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
(6)根据上述实验结果,该反应的平衡常数K的计算式为________ 。
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为_______ (用含K和k正的代数式表示)。
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

(8)A点时,CH3COOCH3(g)的平衡分压为________ ,CH3CH2OH(g)的体积分数为________ %(保留一位小数)。
(9)此温度下,该反应的化学平衡常数Kp=______ MPa-1(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
2SO3(g) ΔH=-196.6kJ•mol-1。(已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500℃时催化剂效果最好)表中列出了在不同温度和压强下,反应达到平衡时SO2的转化率。| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是
(2)在实际生产中,选定的温度为400~500℃,原因是
(3)在实际生产中,采用的压强为常压,原因是
(4)在实际生产中,通入过量的空气,原因是
(5)尾气中SO2必须回收,原因是
II.Bodenstein研究了反应:2HI(g)
 H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:
H2(g)+I2(g) ΔH>0。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表所示:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.6 | 0.73 | 0.773 | 0.78 | 0.784 |
(6)根据上述实验结果,该反应的平衡常数K的计算式为
(7)上述反应中,正反应速率v正=k正x2(HI),逆反应速率v逆=k逆x(H2)•x(I2),其中k正、k逆为正、逆反应速率常数,则k逆为
III.在刚性容器压强为1.01MPa时,乙酸甲酯与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g)。一定温度下,以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
(8)A点时,CH3COOCH3(g)的平衡分压为
(9)此温度下,该反应的化学平衡常数Kp=
您最近一年使用:0次
名校
解题方法
9 . 在人们高度重视环境和保护环境的今天,消除和利用硫氧化物、氮氧化物、碳氧化物对改善大气质量具有重要的意义。
(1)在绝热的某刚性容器中置入 和
和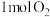 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有___________ (填数字序号)。
①容器中 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗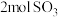
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2
(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:
 =
= 。
。
①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是___________ (填字母)。
②实验测得反应2CO(g)+2NO(g) 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
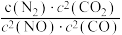 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向___________ 移动(填“正反应方向”“逆反应方向”或“不”)。k正增大的倍数___________ (填“>”、“<”或“=”)k逆增大的倍数。
(3)已知:
 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
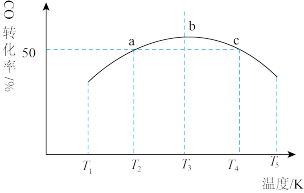
①
___________ 0(填“>”或“<”)。
②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是___________ 。
③已知c点时容器内的压强为p,在 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为___________ (用含p的关系式表示)。( 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)在绝热的某刚性容器中置入
 和
和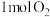 ,发生反应:
,发生反应:
 。下列说法中能够判断该反应一定处于平衡状态的有
。下列说法中能够判断该反应一定处于平衡状态的有①容器中
 、
、 、
、 共存 ②单位时间内生成
共存 ②单位时间内生成 的同时消耗
的同时消耗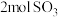
③反应容器中压强不随时间变化 ④容器中温度恒定不变
⑤容器中
 、
、 、
、 的物质的量之比为2∶1∶2
的物质的量之比为2∶1∶2(2)氮氧化物是造成光化学污染的罪魁祸首,用一氧化碳还原氮氧化物,可防止氮氧化物污染,如反应:

 =
= 。
。①已知该反应在不同条件下的化学反应速率如下:
a.v(CO)=1.5 mol·L-1·min-1 b.v(NO)=0.03 mol·L-1·s-1
c.v(N2)=0.6 mol·L-1·min-1 d.v(CO2)=1.6 mol·L-1·min-1
上述4种情况反应速率最快的是
②实验测得反应2CO(g)+2NO(g)
 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)  =
= ,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
,v正=k正•c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。在一定温度下达到平衡时v正 = v逆,则
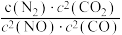 ,达到平衡后,仅升高温度,平衡向
,达到平衡后,仅升高温度,平衡向(3)已知:

 。将1mol CO和
。将1mol CO和 充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下发生反应,相同时间内测得CO的转化率与温度的对应关系如图所示:
①

②由图可知,T3前反应中CO的转化率随温度升高而增大,原因是
③已知c点时容器内的压强为p,在
 温度下该反应的压强平衡常数
温度下该反应的压强平衡常数 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数)
为以分压表示的平衡常数,分压=总压×物质的量分数)
您最近一年使用:0次
名校
解题方法
10 . 完成下列问题
(1)如图为计算机模拟的甲醇(CH3OH)制氢的反应历程,其中吸附在催化剂表面上的物种用*标注。
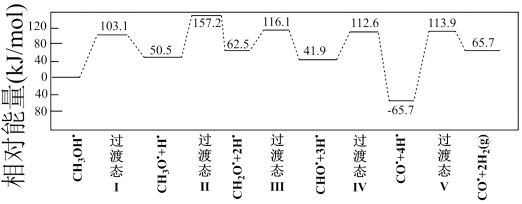
所有历程中最小能垒(活化能)E正=___________ ,决速步骤的化学方程式是___________ 。
(2)在容积可变的密闭容器中发生反应:mA (g)+nB (g) pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105Pa增加到5×105Pa时,平衡 ___________ 移动(填:“向左”、“向右”或“不”)。
②当压强为1×106Pa时,平衡___________ 移动(域:“向左”、“向右”或“不”),写出此时反应的平衡常数表达或:K=___________ 。
(3)温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)=2NO2(g) ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)•c(O2),v逆=v(NO2)消耗=k逆c2(NO2),(k正,k逆为速率常数,受温度影响)。
①温度为T1时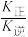 =
=___________ (填数据);当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m ___________ n(填“>”“<”或“=”)。
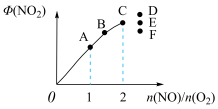
②T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随 的变化如图所示,当
的变化如图所示,当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的 ___________ 。
(1)如图为计算机模拟的甲醇(CH3OH)制氢的反应历程,其中吸附在催化剂表面上的物种用*标注。

所有历程中最小能垒(活化能)E正=
(2)在容积可变的密闭容器中发生反应:mA (g)+nB (g)
 pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC (g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L﹣1 | 0.08 | 0.20 | 0.44 |
②当压强为1×106Pa时,平衡
(3)温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)=2NO2(g) ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)•c(O2),v逆=v(NO2)消耗=k逆c2(NO2),(k正,k逆为速率常数,受温度影响)。
| 物质的起始浓度/mol•L-1 | 物质的平衡浓度mol•L-1 | ||
| c(NO) | c(O2) | c(NO2) | c(O2) |
| 0.6 | 0.3 | 0 | 0.2 |
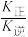 =
=②T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随
 的变化如图所示,当
的变化如图所示,当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的 
您最近一年使用:0次



