1 . 在25℃时,恒容密闭容器中X、Y、Z三种气体的初始浓度和2min后达到平衡的浓度如表所示,下列说法不正确的是
| 物质 | X | Y | Z |
初始浓度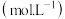 | 1 | 2 | 0 |
平衡浓度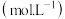 | 0.5 | 0.5 | 1 |
A.反应可表示为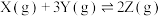 | B.Y的平衡转化率为75% |
| C.反应前后气体总压强之比为3∶2 | D.化学平衡常数为4 |
您最近一年使用:0次
解题方法
2 . 亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应2NO(g)+Cl2(g) 2ClNO(g)获得。
2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) 2ClNO(g) K3
2ClNO(g) K3
则K3=___________ (用K1和K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
则反应2NO(g)+Cl2(g) 2ClNO(g)的ΔH=
2ClNO(g)的ΔH=___________ kJ·mol-1(用含a的代数式表示)。
(3)按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①该反应的ΔH___________ (填“>”“<”或“=”)0。
②在压强为p的条件下,M点时容器内NO的体积分数为___________ 。
③若反应一直保持在压强为p条件下进行,则M点的压强平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数(φ)随 的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是
的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是___________ 点,当 =1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
=1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的___________ 点。

 2ClNO(g)获得。
2ClNO(g)获得。(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1②4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2③2NO(g)+Cl2(g)
 2ClNO(g) K3
2ClNO(g) K3则K3=
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl—Cl | Cl—N | N=O |
| 键能/kJ·mol-1 | 630 | 243 | a | 607 |
 2ClNO(g)的ΔH=
2ClNO(g)的ΔH=(3)按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①该反应的ΔH
②在压强为p的条件下,M点时容器内NO的体积分数为
③若反应一直保持在压强为p条件下进行,则M点的压强平衡常数Kp=
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数(φ)随
 的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是
的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是 =1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
=1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
您最近一年使用:0次
解题方法
3 . Ⅰ.在密闭容器中充入2molN2和6molH2,容器体积为5L,在一定温度下催化反应N2(g)+3H2(g) 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
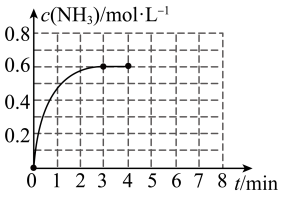
(1)①前3min内平均反应速率:v(H2)=______ ;
②平衡时,N2的转化率为_______ ;反应前后压强之比P前:P后=______ 。
③在此温度下,上述反应平衡常数K=______ 。
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(2)根据反应①与②可推导出K3=________ (用K1、K2表示);△H3_____ 0(用“>”或“<”表示);
(3)下列图像符合反应③的是_______。
 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
(1)①前3min内平均反应速率:v(H2)=
②平衡时,N2的转化率为
③在此温度下,上述反应平衡常数K=
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
| 化学反应 | 平衡常数符号 | 平衡常数值 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H3 | K3 | |||
(2)根据反应①与②可推导出K3=
(3)下列图像符合反应③的是_______。
A.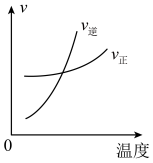 | B. |
C. | D.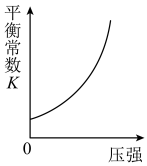 |
您最近一年使用:0次
解题方法
4 . 回答下列问题。
(1)已知可逆反应: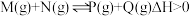 ,请回答下列问题:
,请回答下列问题:
①在某温度下,反应物的起始浓度分别为: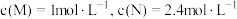 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为_______ ;平衡常数是多少?(写出计算过程)
②若反应温度升高,M的转化率_______ (填“增大”“减小”或“不变”;)
③若反应温度不变,反应物的起始浓度分别为: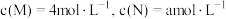 ;达到平衡后,
;达到平衡后,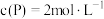 ,则
,则
_______ ;
(2)用酸性 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。
实验前先用酸性 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。
反应原理: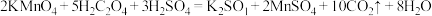 。
。
实验操作:取 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
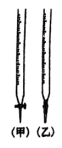
①滴定时,用_______ 滴定管盛装标准酸性 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为_______ 。
②实验时记录的实验数据如下,试计算所测 溶液的浓度为
溶液的浓度为_______  。
。
(1)已知可逆反应:
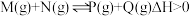 ,请回答下列问题:
,请回答下列问题:①在某温度下,反应物的起始浓度分别为:
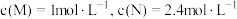 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为②若反应温度升高,M的转化率
③若反应温度不变,反应物的起始浓度分别为:
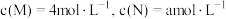 ;达到平衡后,
;达到平衡后,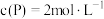 ,则
,则
(2)用酸性
 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。实验前先用酸性
 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。反应原理:
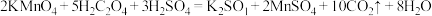 。
。实验操作:取
 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
①滴定时,用
 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为②实验时记录的实验数据如下,试计算所测
 溶液的浓度为
溶液的浓度为 。
。| 实验次数编号 | 待测液体积 | 滴入的标准液体积 |
| 1 | 20.00 | 16.05 |
| 2 | 20.00 | 15.95 |
| 3 | 20.00 | 16.00 |
您最近一年使用:0次
解题方法
5 . 一个化学反应在给定条件(通常指温度、压强)下能否自发进行以及在什么条件下有可能按预期的方向发生,需寻求一种客观的判据,用它来判断一个化学反应能否正向自发进行。研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
(1)下列关于自发反应的叙述,正确的是___________。
(2)下列说法中正确的是___________。
(3)某温度下,可逆反应 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。
(4)在一定温度下,下列反应的化学平衡常数数值如下:
①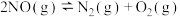
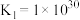
②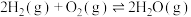
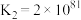
③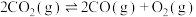
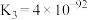
下列说法正确的是___________。
(5)在某密闭容器中把CO和 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。
(6)地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: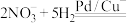

①氮肥 溶于水的过程中熵值
溶于水的过程中熵值___________ (填“增大”或“减小”),Pd/Cu双金属催化剂___________ (填“是”或“不是”)决定反应自发发生的决定因素。
②已知: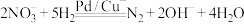 的
的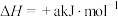 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应___________ (填“能”“不能”或“无法判断是否能”)自发进行。
(7)在一定体积的密闭容器中进行如下化学反应:
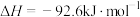 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:
①试判断
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
②T℃( )的某时刻下,
)的某时刻下, ,
,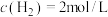 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态___________ (选填“是”或“否”),此时反应速率是
___________  (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是___________ 。
(1)下列关于自发反应的叙述,正确的是___________。
| A.自发反应的逆过程在相同条件下也必定是自发的 |
| B.铁在潮湿的空气中生锈属于非自发反应 |
| C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是自发过程 |
| D.自发反应与外界条件无关 |
A.若 , , ,化学反应在任何温度下都能自发进行 ,化学反应在任何温度下都能自发进行 |
B.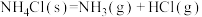 在室温下不能自发进行,则该反应的 在室温下不能自发进行,则该反应的 |
C. 在低温下能自发进行,则该反应的 在低温下能自发进行,则该反应的 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。| A.温度越高,K一定越大 |
B.如果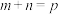 ,则 ,则 |
| C.若缩小反应器的容积,增大压强,则K增大 |
| D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
①
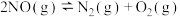
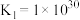
②
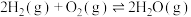
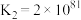
③
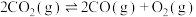
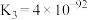
下列说法正确的是___________。
A.该温度下,反应①的平衡常数表达式为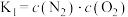 |
B.该温度下,反应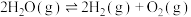 的平衡常数的数值约为 的平衡常数的数值约为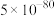 |
C.该温度下,反应①、反应②的逆反应、反应③产生 的倾向由大到小的顺序为 的倾向由大到小的顺序为 |
| D.以上说法都不正确 |
 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。| A.40% | B.50% | C.60% | D.83.3% |
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: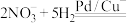

①氮肥
 溶于水的过程中熵值
溶于水的过程中熵值②已知:
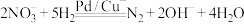 的
的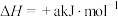 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应(7)在一定体积的密闭容器中进行如下化学反应:

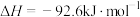 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:| T℃ | 25 | 125 | 225 |
| K | 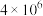 |  |  |

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)②T℃(
 )的某时刻下,
)的某时刻下, ,
,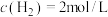 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态
 (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是
您最近一年使用:0次
名校
6 . 在一定温度下的可逆反应X(g) 2Y(g)
2Y(g)  >0,v正=k正c(X),v逆=k逆c2(Y)(k为速率常数),若在该温度下的k正=10k逆,下列说法错误的是
>0,v正=k正c(X),v逆=k逆c2(Y)(k为速率常数),若在该温度下的k正=10k逆,下列说法错误的是
 2Y(g)
2Y(g)  >0,v正=k正c(X),v逆=k逆c2(Y)(k为速率常数),若在该温度下的k正=10k逆,下列说法错误的是
>0,v正=k正c(X),v逆=k逆c2(Y)(k为速率常数),若在该温度下的k正=10k逆,下列说法错误的是| A.该温度下的平衡常数为10 |
| B.升高温度,k正增大的倍数大于k逆增大的倍数 |
| C.有利于测定X的相对分子质量的条件为高温低压 |
| D.恒压条件下,向平衡体系中充入惰性气体He,X的转化率增大 |
您最近一年使用:0次
2024-03-19更新
|
82次组卷
|
2卷引用:浙江省杭州市精诚联盟2023-2024学年高二上学期12月月考化学试题
7 . 完成下列问题。
I.
(1)已知在448℃时,反应H2(g)+I2(g)⇌2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)⇌H2(g)+I2(g)的平衡常数K2为____ ;反应 H2(g)+
H2(g)+ I2(g)⇌HI(g)的平衡常数K3为
I2(g)⇌HI(g)的平衡常数K3为_____ 。
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(2)该反应的化学平衡常数表达式为K=_______ 。
(3)该反应为_______ 反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是_______。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______ ℃。
(6)为了减少CO的排放,某环境研究小组以CO和 为原料合成清洁能源二甲醚(
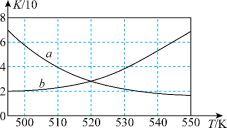
为原料合成清洁能源二甲醚( ),反应如下:
),反应如下: 。如图所示能正确反映平衡常数K随温度变化关系的曲线为
。如图所示能正确反映平衡常数K随温度变化关系的曲线为_______ (填曲线标记字母),其判断理由是_______ 。
I.
(1)已知在448℃时,反应H2(g)+I2(g)⇌2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)⇌H2(g)+I2(g)的平衡常数K2为
 H2(g)+
H2(g)+ I2(g)⇌HI(g)的平衡常数K3为
I2(g)⇌HI(g)的平衡常数K3为Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应的化学平衡常数表达式为K=
(3)该反应为
(4)能判断该反应达到化学平衡状态的依据是_______。
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v(H2)正=v(H2O)逆 | D.c(CO2)=c(CO) |
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(6)为了减少CO的排放,某环境研究小组以CO和
 为原料合成清洁能源二甲醚(
为原料合成清洁能源二甲醚( ),反应如下:
),反应如下: 。如图所示能正确反映平衡常数K随温度变化关系的曲线为
。如图所示能正确反映平衡常数K随温度变化关系的曲线为
您最近一年使用:0次
8 . 可逆反应一定温度下,在10L密闭容器中加入5mol Cl2 (g)和3mol H2O(g),发生反应:2Cl2 (g)+2H2O(g) 4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)
(1)降低温度,υ正_________ ,υ逆_____________ ,Cl2的转化率_______ 。
(2)保持容器体积不变,加入He,则HCl的物质的量______________ 。
(3)保持容器的压强不变,加入He,则 O2的体积分数________ 。
(4)反应生成了________ mol HCl,H2O(g)的转化率是________ 。
(5)平衡时容器内气体的化学平衡常数为________ 。
 4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)(1)降低温度,υ正
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器的压强不变,加入He,则 O2的体积分数
(4)反应生成了
(5)平衡时容器内气体的化学平衡常数为
您最近一年使用:0次
解题方法
9 . 已知反应在某温度下,①CO(g)+CuO(s) CO2(g)+Cu(s) ΔH 1= -126 kJ·mol-1 K1
CO2(g)+Cu(s) ΔH 1= -126 kJ·mol-1 K1
②H2(g)+CuO(s) H2O(g) +Cu(s) ΔH2 = -85 kJ·mol-1 K2
H2O(g) +Cu(s) ΔH2 = -85 kJ·mol-1 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 K3
CO2(g)+H2(g) ΔH3 K3
下列说法正确的是
 CO2(g)+Cu(s) ΔH 1= -126 kJ·mol-1 K1
CO2(g)+Cu(s) ΔH 1= -126 kJ·mol-1 K1②H2(g)+CuO(s)
 H2O(g) +Cu(s) ΔH2 = -85 kJ·mol-1 K2
H2O(g) +Cu(s) ΔH2 = -85 kJ·mol-1 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3 K3
CO2(g)+H2(g) ΔH3 K3下列说法正确的是
| A.反应①为吸热反应 |
| B.1mol H2(g)和1mol CuO(s)具有的总能量低于1molH2O(g)和1mol Cu(s)的总能量 |
C.反应③的反应热ΔH2 = -41 kJ·mol-1、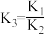 |
| D.升高温度,三个反应的平衡常数K1、K2、K3均变大 |
您最近一年使用:0次
解题方法
10 . (Ⅰ)甲醇是一种重要的化工原料,具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g)。
(1)CO的平衡转化率与温度、压强的关系如图所示。p1、p2的大小关系是p1___________ p2(填“>”“<"或"=”)。___________ 。
(3)下列叙述能说明上述反应能达到化学平衡状态的是___________ (填字母)。
a.2v正(H2)=v逆(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗0.04molH2,生成0.02molCO
(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___________ ℃
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应___________ 达到平衡(填“是”或“否”)。
(1)CO的平衡转化率与温度、压强的关系如图所示。p1、p2的大小关系是p1

(3)下列叙述能说明上述反应能达到化学平衡状态的是
a.2v正(H2)=v逆(CH3OH)
b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗0.04molH2,生成0.02molCO
(Ⅱ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应
您最近一年使用:0次



