解题方法
1 . 甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =_______ 。
(2)若在绝热恒容 的容器内进行反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g),初始加入2mol CH3OH和3mol O2下列不能 表示该反应达到平衡状态的有__________ (填字母序号)。
A.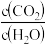 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化
C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变_______ ,初始压强为P,该反应的压强平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)_____ v(逆)(填“>”、“<”或“=”);
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为______ 。
Ⅰ.工业生产甲醇的常用方法是:CO(g)+2H2(g)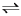 CH3OH(g) △H = -91 kJ/mol。
CH3OH(g) △H = -91 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H = -570 kJ/mol
(1)计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H =
(2)若在
A.
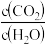 保持不变 B.容器中混合气体的密度不变化
保持不变 B.容器中混合气体的密度不变化C.2v正(H2O)=v逆(CO2) D.容器中混合气体的压强不变化
E. 平均相对分子量保持不变 F. K值保持不变
Ⅱ.制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)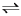 H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应,若起始时向2L容器中充入1 mol CO和1 mol H2O,5min达到平衡时,CO的转化率为60%,试回答下列问题:
(4)若再次向容器中充入0.5mol H2和0.5mol CO,则此时该反应v(正)
(5)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。该电池负极反应的离子方程式为
您最近一年使用:0次
2 . 近年来,改善环境是科学研究的重要课题,对实现碳循环及废气资源的再利用技术的发展都具有重要意义,请回答下列问题:
(1)CO催化加氢制 ,有利于减少有害气体CO。CO加氢制
,有利于减少有害气体CO。CO加氢制 的总反应可表示为
的总反应可表示为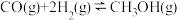 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:
①
②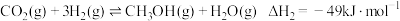
总反应的
_______ 
(2)一定条件下, 和
和 发生反应:
发生反应: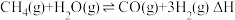 ,设起始
,设起始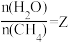 ,在恒压下,反应达到平衡时
,在恒压下,反应达到平衡时 的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是_______。
的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是_______。
(3)在T1℃时,往10L的某恒容密闭容器中充入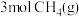 和
和 ,发生反应
,发生反应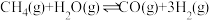 ,
,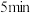 后该反应达到平衡,此时测得混合气体的总物质的量为起始总物质的量的1.5倍,则:
后该反应达到平衡,此时测得混合气体的总物质的量为起始总物质的量的1.5倍,则:
①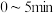 内,
内,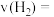
_______ 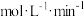 ,
, 的平衡转化率为
的平衡转化率为_______ %。
②该反应的平衡常数K=_______ 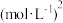 。
。
(4)利用电催化可将 同时转化为多种燃料,装置如图:
同时转化为多种燃料,装置如图: 的电极反应式为
的电极反应式为_______ 。
②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为_______ 。
(1)CO催化加氢制
 ,有利于减少有害气体CO。CO加氢制
,有利于减少有害气体CO。CO加氢制 的总反应可表示为
的总反应可表示为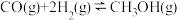 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:①

②
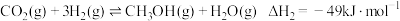
总反应的


(2)一定条件下,
 和
和 发生反应:
发生反应: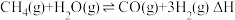 ,设起始
,设起始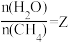 ,在恒压下,反应达到平衡时
,在恒压下,反应达到平衡时 的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是_______。
的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是_______。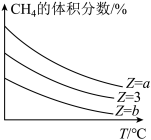
| A.若氢气的物质的量分数不再随时间而改变,则该反应达到平衡 |
B.加入合适的催化剂,该反应的平衡转化率和 的值均增大 的值均增大 |
| C.当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡 |
| D.图中Z的大小a>3>b |
(3)在T1℃时,往10L的某恒容密闭容器中充入
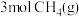 和
和 ,发生反应
,发生反应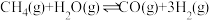 ,
,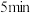 后该反应达到平衡,此时测得混合气体的总物质的量为起始总物质的量的1.5倍,则:
后该反应达到平衡,此时测得混合气体的总物质的量为起始总物质的量的1.5倍,则:①
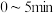 内,
内,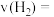
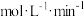 ,
, 的平衡转化率为
的平衡转化率为②该反应的平衡常数K=
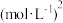 。
。(4)利用电催化可将
 同时转化为多种燃料,装置如图:
同时转化为多种燃料,装置如图: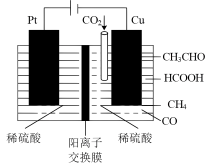
 的电极反应式为
的电极反应式为②5.6L(标准状况下)CO2通入铜电极,若只生成CO和CH4,此时铜极区溶液增重5.4g ,则生成CO和CH4的体积比为
您最近一年使用:0次
名校
解题方法
3 . 一定温度下体积为 的密闭容器中:
的密闭容器中: 的
的 ,在此温度下该容器中含有
,在此温度下该容器中含有 、
、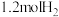 、
、 、
、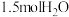 ,判断此时反应
,判断此时反应 和
和 的相对大小并说明理由
的相对大小并说明理由_______ 。
 的密闭容器中:
的密闭容器中: 的
的 ,在此温度下该容器中含有
,在此温度下该容器中含有 、
、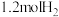 、
、 、
、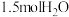 ,判断此时反应
,判断此时反应 和
和 的相对大小并说明理由
的相对大小并说明理由
您最近一年使用:0次
4 . 在25℃时,恒容密闭容器中X、Y、Z三种气体的初始浓度和2min后达到平衡的浓度如表所示,下列说法不正确的是
| 物质 | X | Y | Z |
初始浓度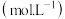 | 1 | 2 | 0 |
平衡浓度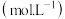 | 0.5 | 0.5 | 1 |
A.反应可表示为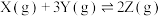 | B.Y的平衡转化率为75% |
| C.反应前后气体总压强之比为3∶2 | D.化学平衡常数为4 |
您最近一年使用:0次
5 . 甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇(CH3OH)。
(1)已知一定条件下,发生反应: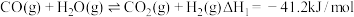 ,
, ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是__________ 。
在体积可变的恒压密闭容器中投入 和
和 ,不同条件下发生上述反应。实验测得平衡时
,不同条件下发生上述反应。实验测得平衡时 的物质的量
的物质的量 随温度
随温度 、压强
、压强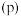 的变化如图1所示。
的变化如图1所示。____________ P2(填“<”或“>”)
(3)M点对应的平衡混合气体的体积为 ,则
,则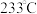 时,该反应的平衡常数
时,该反应的平衡常数
__________ , 的转化率为
的转化率为__________________ (保留1位小数)。
(4)工业上可利用甲醇茾基化法进一步制取甲酸甲酯: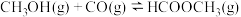 。在容积不变的密闭容器中,投入等物质的量的
。在容积不变的密闭容器中,投入等物质的量的 和
和 ,相同时间内
,相同时间内 的转化率随温度变化如图2所示(不考虑其他副反应)。
的转化率随温度变化如图2所示(不考虑其他副反应)。______________ 。
②该反应是______________ (填“放热”或“吸热”)反应。
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由___________________ 。
(1)已知一定条件下,发生反应:
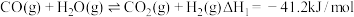 ,
, ,该条件下,水煤气转化成甲醇的热化学方程式是
,该条件下,水煤气转化成甲醇的热化学方程式是在体积可变的恒压密闭容器中投入
 和
和 ,不同条件下发生上述反应。实验测得平衡时
,不同条件下发生上述反应。实验测得平衡时 的物质的量
的物质的量 随温度
随温度 、压强
、压强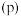 的变化如图1所示。
的变化如图1所示。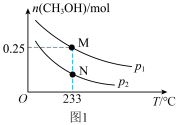
(3)M点对应的平衡混合气体的体积为
 ,则
,则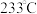 时,该反应的平衡常数
时,该反应的平衡常数
 的转化率为
的转化率为(4)工业上可利用甲醇茾基化法进一步制取甲酸甲酯:
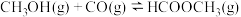 。在容积不变的密闭容器中,投入等物质的量的
。在容积不变的密闭容器中,投入等物质的量的 和
和 ,相同时间内
,相同时间内 的转化率随温度变化如图2所示(不考虑其他副反应)。
的转化率随温度变化如图2所示(不考虑其他副反应)。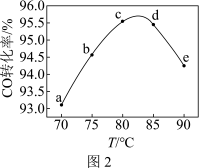
②该反应是
③曲线ac段和de段的变化趋势不同。试从反应速率和平衡角度说明理由
您最近一年使用:0次
名校
解题方法
6 . CO2催化加氢制甲醇是极具前景的温室气体资源化研究领域。在某CO2催化加氢制甲醇的反应体系中发生的主要反应有:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1
iii.CO(g)+2H2(g) CH3OH(g) △H3=-90kJ•mol-1
CH3OH(g) △H3=-90kJ•mol-1
回答下列问题:
(1)△H1=________ kJ/mol。
(2)若反应i的△S=-175J•mol-1•K-1,下列温度下反应能自发进行的是_______ 。
(3)已知几种化学键的键能数据如表所示:
则CO中的C≡O的键能E=_______ kJ/mol。
(4)反应i的进程与体系能量如图所示。下列说法错误的是_______ 。
10MPa时,往某恒容密闭容器中按投料比n(CO2):n(H2)=1:3充入CO2和H2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。_______ 1。(填“>”“<”或“=”)。
(6)图中X、Y分别代表_______ 、_______ (填化学式)。
(7)温度一定时,增大压强,CO2平衡转化率______ 。(填“增大”“减小”或“不变”)。
i.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1ii.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1iii.CO(g)+2H2(g)
 CH3OH(g) △H3=-90kJ•mol-1
CH3OH(g) △H3=-90kJ•mol-1回答下列问题:
(1)△H1=
(2)若反应i的△S=-175J•mol-1•K-1,下列温度下反应能自发进行的是
| A.5℃ | B.20℃ | C.100℃ | D.200℃ |
(3)已知几种化学键的键能数据如表所示:
| 化学键 | C-H | O-H | C-O | H-H |
| 键能/(kJ•mol-1) | 413 | 463 | 351 | 436 |
(4)反应i的进程与体系能量如图所示。下列说法错误的是

| A.反应①为吸热反应,总反应为放热反应 |
| B.反应②可表示为CO+2H2=CH3OH |
| C.反应①的活化能比反应②的大 |
| D.反应②的速率小于反应①,是慢反应 |
10MPa时,往某恒容密闭容器中按投料比n(CO2):n(H2)=1:3充入CO2和H2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

(6)图中X、Y分别代表
(7)温度一定时,增大压强,CO2平衡转化率
您最近一年使用:0次
解题方法
7 . 亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应2NO(g)+Cl2(g) 2ClNO(g)获得。
2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) 2ClNO(g) K3
2ClNO(g) K3
则K3=___________ (用K1和K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
则反应2NO(g)+Cl2(g) 2ClNO(g)的ΔH=
2ClNO(g)的ΔH=___________ kJ·mol-1(用含a的代数式表示)。
(3)按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①该反应的ΔH___________ (填“>”“<”或“=”)0。
②在压强为p的条件下,M点时容器内NO的体积分数为___________ 。
③若反应一直保持在压强为p条件下进行,则M点的压强平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数(φ)随 的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是
的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是___________ 点,当 =1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
=1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的___________ 点。

 2ClNO(g)获得。
2ClNO(g)获得。(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1②4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2③2NO(g)+Cl2(g)
 2ClNO(g) K3
2ClNO(g) K3则K3=
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl—Cl | Cl—N | N=O |
| 键能/kJ·mol-1 | 630 | 243 | a | 607 |
 2ClNO(g)的ΔH=
2ClNO(g)的ΔH=(3)按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①该反应的ΔH
②在压强为p的条件下,M点时容器内NO的体积分数为
③若反应一直保持在压强为p条件下进行,则M点的压强平衡常数Kp=
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数(φ)随
 的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是
的变化关系如图B所示。则A、B、C三点对应状态中,NO的转化率最大的是 =1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
=1.5时,达到平衡状态时ClNO的体积分数φ可能对应D、E、F三点中的
您最近一年使用:0次
解题方法
8 . Ⅰ.在密闭容器中充入2molN2和6molH2,容器体积为5L,在一定温度下催化反应N2(g)+3H2(g) 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
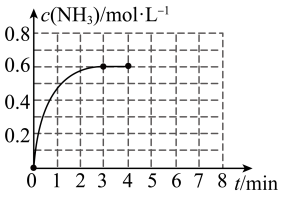
(1)①前3min内平均反应速率:v(H2)=______ ;
②平衡时,N2的转化率为_______ ;反应前后压强之比P前:P后=______ 。
③在此温度下,上述反应平衡常数K=______ 。
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(2)根据反应①与②可推导出K3=________ (用K1、K2表示);△H3_____ 0(用“>”或“<”表示);
(3)下列图像符合反应③的是_______。
 2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
2NH3(g),NH3的物质的量浓度随时间的变化如图所示。
(1)①前3min内平均反应速率:v(H2)=
②平衡时,N2的转化率为
③在此温度下,上述反应平衡常数K=
Ⅱ.工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
| 化学反应 | 平衡常数符号 | 平衡常数值 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H3 | K3 | |||
(2)根据反应①与②可推导出K3=
(3)下列图像符合反应③的是_______。
A.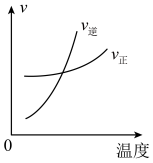 | B.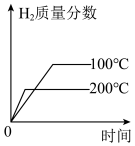 |
C.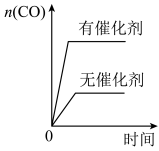 | D.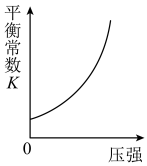 |
您最近一年使用:0次
解题方法
9 . 回答下列问题。
(1)已知可逆反应: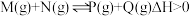 ,请回答下列问题:
,请回答下列问题:
①在某温度下,反应物的起始浓度分别为: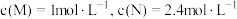 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为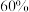 ,此时N的转化率为
,此时N的转化率为_______ ;平衡常数是多少?(写出计算过程)
②若反应温度升高,M的转化率_______ (填“增大”“减小”或“不变”;)
③若反应温度不变,反应物的起始浓度分别为: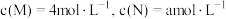 ;达到平衡后,
;达到平衡后,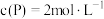 ,则
,则
_______ ;
(2)用酸性 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。
实验前先用酸性 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。
反应原理: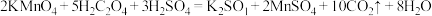 。
。
实验操作:取 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
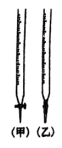
①滴定时,用_______ 滴定管盛装标准酸性 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为_______ 。
②实验时记录的实验数据如下,试计算所测 溶液的浓度为
溶液的浓度为_______  。
。
(1)已知可逆反应:
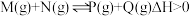 ,请回答下列问题:
,请回答下列问题:①在某温度下,反应物的起始浓度分别为:
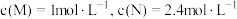 ;达到平衡后,M的转化率为
;达到平衡后,M的转化率为 ,此时N的转化率为
,此时N的转化率为②若反应温度升高,M的转化率
③若反应温度不变,反应物的起始浓度分别为:
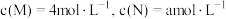 ;达到平衡后,
;达到平衡后,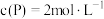 ,则
,则
(2)用酸性
 溶液与
溶液与 溶液反应来探究“外界条件对化学反应速率的影响”。
溶液反应来探究“外界条件对化学反应速率的影响”。实验前先用酸性
 标准溶液滴定未知浓度的草酸。
标准溶液滴定未知浓度的草酸。反应原理:
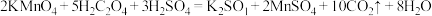 。
。实验操作:取
 待测
待测 溶液放入锥形瓶中,用
溶液放入锥形瓶中,用 酸性
酸性 标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
标准溶液进行滴定。重复上述滴定操作2~3次,并记录数据。
①滴定时,用
 溶液(填“甲”或“乙”滴定终点的现象为
溶液(填“甲”或“乙”滴定终点的现象为②实验时记录的实验数据如下,试计算所测
 溶液的浓度为
溶液的浓度为 。
。| 实验次数编号 | 待测液体积 | 滴入的标准液体积 |
| 1 | 20.00 | 16.05 |
| 2 | 20.00 | 15.95 |
| 3 | 20.00 | 16.00 |
您最近一年使用:0次
解题方法
10 . 一个化学反应在给定条件(通常指温度、压强)下能否自发进行以及在什么条件下有可能按预期的方向发生,需寻求一种客观的判据,用它来判断一个化学反应能否正向自发进行。研究表明,可逆反应在适当条件下进行一段时间后一定会达到化学平衡状态。在研究了大量实验的基础上,人们发现可以用化学平衡常数来定量描述化学反应的限度。
(1)下列关于自发反应的叙述,正确的是___________。
(2)下列说法中正确的是___________。
(3)某温度下,可逆反应 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。
(4)在一定温度下,下列反应的化学平衡常数数值如下:
①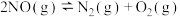
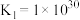
②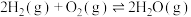
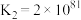
③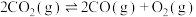
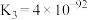
下列说法正确的是___________。
(5)在某密闭容器中把CO和 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。
(6)地下水中的氮污染主要是由 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: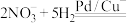

①氮肥 溶于水的过程中熵值
溶于水的过程中熵值___________ (填“增大”或“减小”),Pd/Cu双金属催化剂___________ (填“是”或“不是”)决定反应自发发生的决定因素。
②已知: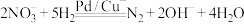 的
的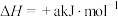 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应___________ (填“能”“不能”或“无法判断是否能”)自发进行。
(7)在一定体积的密闭容器中进行如下化学反应:
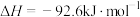 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:
①试判断
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
②T℃( )的某时刻下,
)的某时刻下, ,
,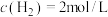 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态___________ (选填“是”或“否”),此时反应速率是
___________  (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是___________ 。
(1)下列关于自发反应的叙述,正确的是___________。
| A.自发反应的逆过程在相同条件下也必定是自发的 |
| B.铁在潮湿的空气中生锈属于非自发反应 |
| C.自发过程可以是物理过程,不一定是自发反应,而自发反应一定是自发过程 |
| D.自发反应与外界条件无关 |
A.若 , , ,化学反应在任何温度下都能自发进行 ,化学反应在任何温度下都能自发进行 |
B.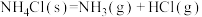 在室温下不能自发进行,则该反应的 在室温下不能自发进行,则该反应的 |
C. 在低温下能自发进行,则该反应的 在低温下能自发进行,则该反应的 |
| D.加入合适的催化剂能降低反应的活化能,从而改变反应的焓变 |
 的平衡常数为K。下列对K的说法正确的是___________。
的平衡常数为K。下列对K的说法正确的是___________。| A.温度越高,K一定越大 |
B.如果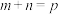 ,则 ,则 |
| C.若缩小反应器的容积,增大压强,则K增大 |
| D.K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
①
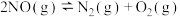
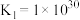
②
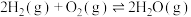
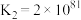
③
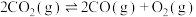
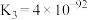
下列说法正确的是___________。
A.该温度下,反应①的平衡常数表达式为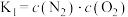 |
B.该温度下,反应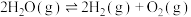 的平衡常数的数值约为 的平衡常数的数值约为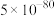 |
C.该温度下,反应①、反应②的逆反应、反应③产生 的倾向由大到小的顺序为 的倾向由大到小的顺序为 |
| D.以上说法都不正确 |
 的混合物加热到800℃,存在平衡:
的混合物加热到800℃,存在平衡: ,且平衡常数
,且平衡常数 。若在2L的密闭容器中充入1molCO和1mol
。若在2L的密闭容器中充入1molCO和1mol 的混合物并加热到800℃,则平衡时CO的转化率为___________。
的混合物并加热到800℃,则平衡时CO的转化率为___________。| A.40% | B.50% | C.60% | D.83.3% |
 引起的,人们对
引起的,人们对 的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,
的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下, 将硝酸盐还原成氮气:
将硝酸盐还原成氮气: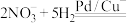

①氮肥
 溶于水的过程中熵值
溶于水的过程中熵值②已知:
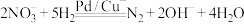 的
的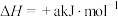 ,
, (a、b均为正值),该反应
(a、b均为正值),该反应(7)在一定体积的密闭容器中进行如下化学反应:

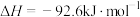 ,其化学平衡常数(K)和温度(T)的关系如下表所示:
,其化学平衡常数(K)和温度(T)的关系如下表所示:| T℃ | 25 | 125 | 225 |
| K |  |  |  |

 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)②T℃(
 )的某时刻下,
)的某时刻下, ,
,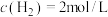 ,
, ,此时该反应是否处于平衡状态
,此时该反应是否处于平衡状态
 (选择“>”、“=”或“<”),其原因是
(选择“>”、“=”或“<”),其原因是
您最近一年使用:0次



