1 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+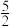 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=_____ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为____ 。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=___ ,上述变化过程中T1____ (填“>”或“<”)T2,判断理由是____ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将____ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比,CH4的平衡转化率____ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应2CH4(g) C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=____ Pa2(用平衡分压代替平衡浓度)。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+
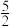 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将
(3)若容器中发生反应2CH4(g)
 C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
您最近一年使用:0次
2022-10-19更新
|
601次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
解题方法
2 . 反应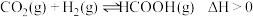 ;
; ,
,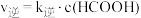 ,
, 、
、 为速率常数;温度为
为速率常数;温度为 时,该反应的平衡常数
时,该反应的平衡常数 。下列说法正确的是
。下列说法正确的是
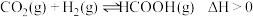 ;
; ,
,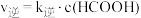 ,
, 、
、 为速率常数;温度为
为速率常数;温度为 时,该反应的平衡常数
时,该反应的平衡常数 。下列说法正确的是
。下列说法正确的是| A.压缩容器体积,活化分子百分数增大 |
B.升高温度, 增大, 增大, 减小 减小 |
C. 时,若 时,若 和 和 等物质的量投料,则 等物质的量投料,则 的平衡转化率为50% 的平衡转化率为50% |
D.当温度改变为 时, 时,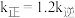 ,则 ,则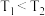 |
您最近一年使用:0次
3 . 向体积为1L的容器中充入4molA,发生反应: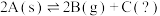 ,不同温度下的平衡常数与达到平衡时B的物质的量如下:
,不同温度下的平衡常数与达到平衡时B的物质的量如下:
下列说法正确的是
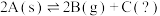 ,不同温度下的平衡常数与达到平衡时B的物质的量如下:
,不同温度下的平衡常数与达到平衡时B的物质的量如下:| 温度 |  |  |
| K | 4 | 1 |
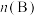 /mol /mol | x | y |
| A.容器中气体的平均摩尔质量不变时,该反应达到平衡 |
B. 时,若平衡时剩余2molA,则C必为气体 时,若平衡时剩余2molA,则C必为气体 |
C. 时,当反应达到平衡后,容器内剩余A的物质的量为3mol 时,当反应达到平衡后,容器内剩余A的物质的量为3mol |
D. 时,若容器的体积变为2L,则平衡时 时,若容器的体积变为2L,则平衡时 mol mol |
您最近一年使用:0次
2023-03-17更新
|
341次组卷
|
2卷引用:上海市普通高中2022年学业水平等级考试化学试题
名校
解题方法
4 . 利用I2O5可消除CO污染,其反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是

 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是
| A.b点时,CO的转化率为80% |
| B.容器内的压强保持恒定,表明反应达到平衡状态 |
| C.b点和d点的化学平衡常数:Kb>Kd |
| D.由起始到a点这段时间的反应速率v(CO)=0.3mol•L-1•min-1 |
您最近一年使用:0次
2022-10-19更新
|
257次组卷
|
2卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
名校
解题方法
5 . 聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)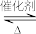 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____ (保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____ ;A、B、C、D四点中,v正最大的是___ ,v逆最大的是____ 。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____ 时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____ 。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
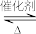 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
您最近一年使用:0次
2020-02-11更新
|
888次组卷
|
7卷引用:山东省2020年普通高中学业水平等级考试模拟试题
山东省2020年普通高中学业水平等级考试模拟试题【省级联考】山东省2020届新高考模拟统考化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)第24讲 化学平衡常数及转化率的计算(精练)-2021年高考化学一轮复习讲练测(已下线)小题29 化学平衡的相关计算——备战2021年高考化学经典小题考前必刷(全国通用)湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题
6 . 某实验将 和
和 充入一定体积的密闭容器中,在不同温度下发生反应:
充入一定体积的密闭容器中,在不同温度下发生反应:
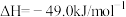 ,测得
,测得 的物质的量随时间变化如下图所示,回答问题:
的物质的量随时间变化如下图所示,回答问题:
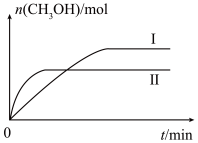
(1)该反应的平衡常数表达式为
_______ 。
(2)曲线I、Ⅱ对应的温度
_______  (填“>”或“<”)。
(填“>”或“<”)。
平衡常数关系为
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)其他条件不变时,下列措施能提高 转化率的是_______(填字母代号)。
转化率的是_______(填字母代号)。
(4)其他条件不变时,将容器体积扩大一倍,平衡向_______ 移动(填“正向”、“逆向”或“不”)
 和
和 充入一定体积的密闭容器中,在不同温度下发生反应:
充入一定体积的密闭容器中,在不同温度下发生反应:
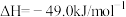 ,测得
,测得 的物质的量随时间变化如下图所示,回答问题:
的物质的量随时间变化如下图所示,回答问题:
(1)该反应的平衡常数表达式为

(2)曲线I、Ⅱ对应的温度

 (填“>”或“<”)。
(填“>”或“<”)。平衡常数关系为

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)其他条件不变时,下列措施能提高
 转化率的是_______(填字母代号)。
转化率的是_______(填字母代号)。A.减小 的浓度 的浓度 | B.降低温度 |
C.增加 的浓度 的浓度 | D.增大压强 |
您最近一年使用:0次
解题方法
7 . 游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”会导致氮向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.
b.
c.
(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式_______ 。
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
(3)在合成氨工业中,为提高化学反应速率并提高原料的平衡转化率可采取的措施为_____(填字母)。
(4)在有氧条件下,新型催化剂M能催化CO与 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。
①现向某密闭容器中充入等物质的量浓度的 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
在0~5min内,以CO2的浓度变化表示的反应速率为_______ mol/(L·min),在10min时,CO的转化率为_______ 。此温度下,该反应的化学平衡常数K=_______ (保留两位有效数字)。
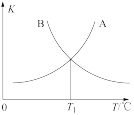
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(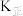 )的是
)的是_______ (填“A”或“B”),原因是_______ 。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.

b.

c.

(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
| A.容器中气体密度不变 | B. |
| C.容器中压强不变 | D.N2、H2、NH3分子数之比为1:3:2 |
| A.升高温度 | B.将氨液化从体系中分离 |
| C.加入催化剂 | D.增大压强 |
 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。①现向某密闭容器中充入等物质的量浓度的
 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
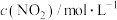 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
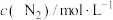 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(
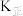 )的是
)的是
您最近一年使用:0次
名校
8 . 利用CO2合成二甲醚的原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比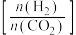 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
 CH3OCH3(g)+3H2O(g) ∆H,其中投料比
CH3OCH3(g)+3H2O(g) ∆H,其中投料比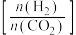 (取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示
(取值为2、3、4)和温度与CO2的平衡转化率的关系如图所示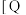 点c(CO2)= 0.2mol·L-1。下列说法正确的是
点c(CO2)= 0.2mol·L-1。下列说法正确的是
| A.T1K时,Kc=0.0675 | B.△H>0 |
C.X表示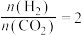 | D.催化剂可以改变CO2的平衡转化率 |
您最近一年使用:0次
2024-04-19更新
|
131次组卷
|
2卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
解题方法
9 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料等。 的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为: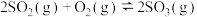
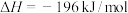 。回答下列问题:
。回答下列问题:
(1)已知 在
在 作用下的催化氧化历程如图所示反应
作用下的催化氧化历程如图所示反应

①的活化能为 ,反应②的活化能为
,反应②的活化能为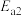 ,则
,则
_______ 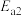 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)当 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为 、
、 和
和 下,
下, 平衡转化率α随温度的变化如图所示。
平衡转化率α随温度的变化如图所示。

① 、
、 和
和 由小到大的顺序为
由小到大的顺序为_______ ,判断的依据是_______ 。
②在550℃、 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若 转化率为α,则压强平衡常数Kp=
转化率为α,则压强平衡常数Kp=_______ 。(分压=总压×物质的量分数,用含α和 的代数式表示,不用写单位)
的代数式表示,不用写单位)
(3)以 为基础固硫材料,探究复合不同的催化剂(
为基础固硫材料,探究复合不同的催化剂( 、
、 -
- 、
、 -
- )在不同温度下催化
)在不同温度下催化 向
向 的转化效率(用单位时间
的转化效率(用单位时间 转化率表示)如图所示:
转化率表示)如图所示:

①仅使用 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是_______ 。
②下列有关说法正确的是_______
a.同温度下,三种催化剂中 催化剂效率最低
催化剂效率最低
b.温度越高一定越有利于催化剂催化效率的提升
c.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
d.催化剂通过改变反应历程,增大活化分子百分数,实现加快反应速率
(4)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: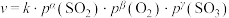 ,根据表中数据,γ=
,根据表中数据,γ=_______ 。
(5)利用 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中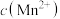 和
和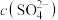 随反应时间的变化如图所示。导致溶液中
随反应时间的变化如图所示。导致溶液中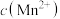 和
和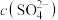 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:_______ 。

 的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为:
的催化氧化是工业合成硫酸中重要的一步,其热化学方程式为: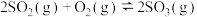
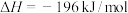 。回答下列问题:
。回答下列问题:(1)已知
 在
在 作用下的催化氧化历程如图所示反应
作用下的催化氧化历程如图所示反应
①的活化能为
 ,反应②的活化能为
,反应②的活化能为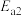 ,则
,则
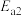 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)(2)当
 、
、 、
、 (不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为
(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在压强为 、
、 和
和 下,
下, 平衡转化率α随温度的变化如图所示。
平衡转化率α随温度的变化如图所示。
①
 、
、 和
和 由小到大的顺序为
由小到大的顺序为②在550℃、
 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若 转化率为α,则压强平衡常数Kp=
转化率为α,则压强平衡常数Kp= 的代数式表示,不用写单位)
的代数式表示,不用写单位)(3)以
 为基础固硫材料,探究复合不同的催化剂(
为基础固硫材料,探究复合不同的催化剂( 、
、 -
- 、
、 -
- )在不同温度下催化
)在不同温度下催化 向
向 的转化效率(用单位时间
的转化效率(用单位时间 转化率表示)如图所示:
转化率表示)如图所示:
①仅使用
 而不使用催化剂获得的X线的实验目的是
而不使用催化剂获得的X线的实验目的是②下列有关说法正确的是
a.同温度下,三种催化剂中
 催化剂效率最低
催化剂效率最低b.温度越高一定越有利于催化剂催化效率的提升
c.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率d.催化剂通过改变反应历程,增大活化分子百分数,实现加快反应速率
(4)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: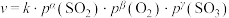 ,根据表中数据,γ=
,根据表中数据,γ=| 实验 |  |  |  | V |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 1.414q |
 与
与 反应既可消除污染又可以制备
反应既可消除污染又可以制备 ,将含有
,将含有 尾气和一定比例的空气通入
尾气和一定比例的空气通入 悬浊液中,保持温度不变的情况下,测得溶液中
悬浊液中,保持温度不变的情况下,测得溶液中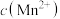 和
和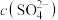 随反应时间的变化如图所示。导致溶液中
随反应时间的变化如图所示。导致溶液中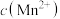 和
和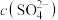 的变化产生明显差异的原因是:
的变化产生明显差异的原因是:
您最近一年使用:0次
解题方法
10 . 在一定条件下,生产化工产品C的反应如下: A(g)+B(g) 2C(g) ∆H < 0 T ℃时,向1 L密闭容器中充入1.0 mol A(g)、1.0 mol B(g),反应过程中C(g)的浓度随时间变化如图所示。
2C(g) ∆H < 0 T ℃时,向1 L密闭容器中充入1.0 mol A(g)、1.0 mol B(g),反应过程中C(g)的浓度随时间变化如图所示。

(1)0 ~10 min内,υ(C) =_____ mol/(L·min)。
(2)仅升高温度,平衡向______ (填“正”或“逆”)反应方向移动。
(3)平衡时,A的转化率是______ 。
(4)该温度下,此反应的化学平衡常数数值为______ 。
 2C(g) ∆H < 0 T ℃时,向1 L密闭容器中充入1.0 mol A(g)、1.0 mol B(g),反应过程中C(g)的浓度随时间变化如图所示。
2C(g) ∆H < 0 T ℃时,向1 L密闭容器中充入1.0 mol A(g)、1.0 mol B(g),反应过程中C(g)的浓度随时间变化如图所示。
(1)0 ~10 min内,υ(C) =
(2)仅升高温度,平衡向
(3)平衡时,A的转化率是
(4)该温度下,此反应的化学平衡常数数值为
您最近一年使用:0次



