1 . 已知: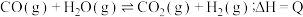 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。
(1)上述反应的化学平衡常数表达式为
___________ 。
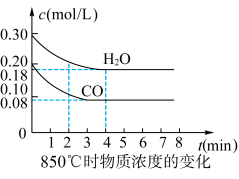
(2) 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率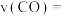
___________ 。
(3)若在 时进行,且
时进行,且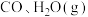 的起始浓度均为
的起始浓度均为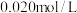 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为___________
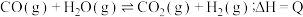 ,其平衡常数随温度变化如下表所示。
,其平衡常数随温度变化如下表所示。温度 | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为

(2)
 时,向体积为
时,向体积为 反应器中通入一定量的
反应器中通入一定量的 和
和 ,发生上述反应,
,发生上述反应, 和
和 浓度变化如图所示,则
浓度变化如图所示,则 时,平均反应速率
时,平均反应速率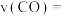

(3)若在
 时进行,且
时进行,且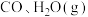 的起始浓度均为
的起始浓度均为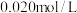 ,该条件下,
,该条件下, 的最大转化率为
的最大转化率为
您最近一年使用:0次
名校
解题方法
2 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: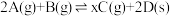 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
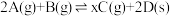 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题
江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题
3 . I.已知在448℃时,反应H2(g)+I2(g)⇌2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)⇌H2(g)+I2(g)的平衡常数K2为______ ;反应 H2(g)+
H2(g)+ I2(g)⇌HI(g)的平衡常数K3为
I2(g)⇌HI(g)的平衡常数K3为______ 。
II.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
回答下列问题:
(1)该反应的逆反应为______ (填“吸热”或“放热”)反应。
(2)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为______ ℃,在此温度下,加入2 mol的CO和3 mol的H2O,达到平衡时,CO的转化率为______ 。
(3)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol•L-1,c(H2)为1.5 mol•L-1,c(CO)为1 mol•L-1,c(H2O)为3 mol•L-1,则下一时刻,反应将______ (填“正向”或“逆向”)进行。
 H2(g)+
H2(g)+ I2(g)⇌HI(g)的平衡常数K3为
I2(g)⇌HI(g)的平衡常数K3为II.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的逆反应为
(2)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
(3)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol•L-1,c(H2)为1.5 mol•L-1,c(CO)为1 mol•L-1,c(H2O)为3 mol•L-1,则下一时刻,反应将
您最近一年使用:0次
名校
4 . 甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________ (用K1、K2表示)。
(2)反应③的ΔH_________ 0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正_____ v逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
①a=______ ,b=_________ ,平衡时H2的转换率为________ (保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________ (填“增大”、“减小”或“不变”)
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
(2)反应③的ΔH
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
①a=
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比
您最近一年使用:0次
10-11高二下·江苏南京·期中
5 . 合成氨反应N2(g)+3H2(g)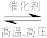 2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3mol·L-1,c(H2)=9mol·L-1,c(NH3)=4mol·L-1,求:①该温度时的平衡常数;②N2、H2的起始浓度。
2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3mol·L-1,c(H2)=9mol·L-1,c(NH3)=4mol·L-1,求:①该温度时的平衡常数;②N2、H2的起始浓度。
 2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3mol·L-1,c(H2)=9mol·L-1,c(NH3)=4mol·L-1,求:①该温度时的平衡常数;②N2、H2的起始浓度。
2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3mol·L-1,c(H2)=9mol·L-1,c(NH3)=4mol·L-1,求:①该温度时的平衡常数;②N2、H2的起始浓度。
您最近一年使用:0次
6 . Na2CO3、NaHCO3及xNa2CO3·yH2O2 (过碳酸钠)在工农业生产上用途非常广泛。
(1)0.1mol·L-1Na2CO3溶液加水稀释时,溶液的pH___________ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka2=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O H2CO3+OH-的平衡常数为K=
H2CO3+OH-的平衡常数为K=___________ (填数值)。
②反应HCO3-+NH3·H2O CO32-+NH4++H2O的平衡常数为K=
CO32-+NH4++H2O的平衡常数为K=___________ (填数值)。
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:
①滴定CO 时,终点溶液颜色变化是
时,终点溶液颜色变化是___________ 。
②滴定H2O2时,MnO 被还原为Mn2+,反应的离子方程式为
被还原为Mn2+,反应的离子方程式为___________ 。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。计算y/x的值(列出计算过程)。
(1)0.1mol·L-1Na2CO3溶液加水稀释时,溶液的pH
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka2=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O
 H2CO3+OH-的平衡常数为K=
H2CO3+OH-的平衡常数为K=②反应HCO3-+NH3·H2O
 CO32-+NH4++H2O的平衡常数为K=
CO32-+NH4++H2O的平衡常数为K=(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO
 时,终点溶液颜色变化是
时,终点溶液颜色变化是②滴定H2O2时,MnO
 被还原为Mn2+,反应的离子方程式为
被还原为Mn2+,反应的离子方程式为③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。计算y/x的值(列出计算过程)。
您最近一年使用:0次
13-14高二下·江苏无锡·期中
7 . 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
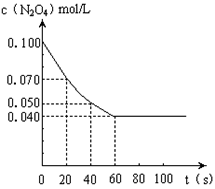
(1)计算在20至40秒时间内,NO2的平均生成速率为____________ mol•L-1•S-1
(2)①该反应的化学平衡常数表达式为__________ ,
(3)求达到平衡状态时N2O4的转化率____________
(4)求平衡时容器内气体压强与反应前的压强之比为__________ (最简整数比)
 2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为
(2)①该反应的化学平衡常数表达式为
②求该温度下平衡常数的值
(3)求达到平衡状态时N2O4的转化率
(4)求平衡时容器内气体压强与反应前的压强之比为
您最近一年使用:0次
11-12高二上·江苏南通·阶段练习
解题方法
8 . 已知几种共价键的键能数据如下:
(1)通过计算,写出合成氨反应的热化学方程式____________________ 。
(2)某温度下,以1 mol N2和3mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,达到平衡时测得反应放热68.1 kJ,试计算N2的转化率__________ 和该温度下的化学平衡常数________________ 。
| 共价键 | N≡N | H-H | N-H |
| 键能/(kJ·mol-1) | 946 | 436 | 390.8 |
(2)某温度下,以1 mol N2和3mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,达到平衡时测得反应放热68.1 kJ,试计算N2的转化率
您最近一年使用:0次
12-13高二上·江苏盐城·期末
9 . 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L,
求:
(1)求该反应的平衡常数。________
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。__________
求:
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。
您最近一年使用:0次
12-13高二上·河南·期中
名校
10 . 一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
 CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
您最近一年使用:0次
2013-11-28更新
|
1044次组卷
|
9卷引用:江苏省镇江第一中学2020-2021学年高二上期末测试化学试题
江苏省镇江第一中学2020-2021学年高二上期末测试化学试题(已下线)2012-2013学年河南省河南大学附中高二上学期期中考试化学试卷(已下线)2013-2014学年江西省南昌市四校联考高二上学期期中考试化学试卷(已下线)2013-2014学年江西省南昌市高二上学期期中测试理科化学试卷(甲)(已下线)2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷河北省大名县第一中学2017-2018学年高二上学期第一次月考化学试题黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题(已下线)2.2.3 化学平衡常数(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)



