解题方法
1 . 在一定条件下,将2 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。
(1)x=_______ ,2min内A的平均反应速率v(A)=_______ 。
(2)B的转化率为_______ ,该温度下反应的平衡常数的值为_______ (结果保留三位有效数字)。
(3)其他条件不变,若再向容器中加入0.2 mol B和0.2 mol C,此时v(正)_______ v(逆)(填“>”“=”或“<”)。
 xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。(1)x=
(2)B的转化率为
(3)其他条件不变,若再向容器中加入0.2 mol B和0.2 mol C,此时v(正)
您最近一年使用:0次
2 . 已知:N2O4(g)⇌2NO2(g) =+52.70 kJ/mol。
=+52.70 kJ/mol。
(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的______
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=_______ ,t℃时反应N2O4(g)⇌2NO2(g)的平衡常数K=________ 。
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数_______ 乙容器N2O4(g)⇌2NO2(g)的平衡常数(填“大于”、“小于”或“等于”),甲容器中N2O4转化率与乙容器中NO2的转化率之和_________ 1(填“大于”、“小于”或“等于”)。
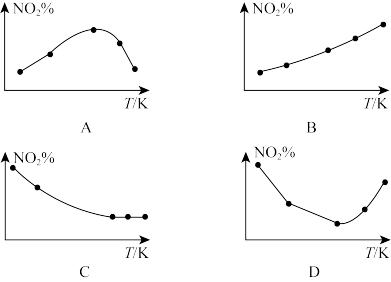
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是__________
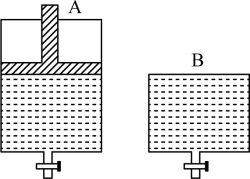
(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入_______ mol NO2,达平衡后A、B两容器的NO2百分含量相等。
 =+52.70 kJ/mol。
=+52.70 kJ/mol。(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入

您最近一年使用:0次
名校
3 . 化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
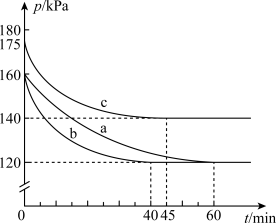
(1)列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=________________ 。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为_______________ (填实验序号);与实验a相比,其他两组改变的实验条件是:b_________________ 、c____________________________________ 。
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为_________________ ;实验a和c的平衡转化率:αa为___________ 、αc为_______________ 。
 AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
(1)列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
您最近一年使用:0次
名校
4 . (1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到25 min时,以N2表示的平均反应速率=____ ;
(2)工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。

下列说法正确的是( )
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB
F.该反应的平衡常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/(4t1) mol/(L.min)
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,达到平衡时测得容器内的压强为起始时的7/9倍,则此温度下的平衡常数为___ 。在同一温度,同一容器中,将起始物质改为amolN2,bmolH2和cmolNH3(a、b、c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a、b、c满足的关系为____ (用含a、b、c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是____ 。
| 反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强 /MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)
 2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
下列说法正确的是
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB
F.该反应的平衡常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/(4t1) mol/(L.min)
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,达到平衡时测得容器内的压强为起始时的7/9倍,则此温度下的平衡常数为
您最近一年使用:0次
名校
5 . 现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:

(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___ 。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____ 。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___ (填“是”与“否”),此时υ(正)__ υ(逆)(填“大于”“小于”或“等于”)。

(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态
您最近一年使用:0次
名校
解题方法
6 . 工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘
(1)该密闭容器的容积是______________ L。
(2)达到平衡状态的时刻是_______________ min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率 (CO2)=
(CO2)=_____________ mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______ 。
(5)该温度下,反应的化学平衡常数数值是____ 。
(6)已知: ① CO(g)+2H2(g) CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____ ,反应在10 min内所放出的热量为_____ kJ.
 CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:‘

(1)该密闭容器的容积是
(2)达到平衡状态的时刻是
(3)在前10min内,用CO2浓度的变化表示的反应速率
 (CO2)=
(CO2)=(4)10min时体系的压强与开始时压强之比为
(5)该温度下,反应的化学平衡常数数值是
(6)已知: ① CO(g)+2H2(g)
 CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
您最近一年使用:0次
2019-09-30更新
|
266次组卷
|
3卷引用:河南省登封市第一高级中学2019-2020学年高二上学期期中考试化学试题
7 . 在一定条件下,可逆反应A2 (g)+B2 (g) 2C (g)达到了化学平衡状态,经测得平衡时c (A2)=0.5 mol·L-1,c (B2)=0.1 mol·L-1,c (C)=1.6 mol·L-1,若A2、B2、C的起始浓度分别以a mol·L-1,b mol·L-1,c mol·L-1表示,请填写下列空白。
2C (g)达到了化学平衡状态,经测得平衡时c (A2)=0.5 mol·L-1,c (B2)=0.1 mol·L-1,c (C)=1.6 mol·L-1,若A2、B2、C的起始浓度分别以a mol·L-1,b mol·L-1,c mol·L-1表示,请填写下列空白。
(1)a、b应满足的关系是_____________________ 。
(2)a的取值范围是_____________________ 。
 2C (g)达到了化学平衡状态,经测得平衡时c (A2)=0.5 mol·L-1,c (B2)=0.1 mol·L-1,c (C)=1.6 mol·L-1,若A2、B2、C的起始浓度分别以a mol·L-1,b mol·L-1,c mol·L-1表示,请填写下列空白。
2C (g)达到了化学平衡状态,经测得平衡时c (A2)=0.5 mol·L-1,c (B2)=0.1 mol·L-1,c (C)=1.6 mol·L-1,若A2、B2、C的起始浓度分别以a mol·L-1,b mol·L-1,c mol·L-1表示,请填写下列空白。(1)a、b应满足的关系是
(2)a的取值范围是
您最近一年使用:0次
名校
8 . (1)已知可逆反应CO(g) + H2O (g) CO2(g) + H2(g),在830K温度下达到平衡。
CO2(g) + H2(g),在830K温度下达到平衡。
①830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,则该反应的平衡常数K=______________ 。
②830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________ 。
(2)已知反应:2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ;则CO的燃烧热为_______ 。
(3)已知:氮气和氢气合成氨反应为:N2(g)+3H2(g) 2NH3(g) ΔH=-92kJ/mol。取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量
2NH3(g) ΔH=-92kJ/mol。取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量___________ 92kJ(填“大于”、“等于”或“小于”);若升高温度,上述反应中ΔH___________ (填“变大”、“变小”或“不变”)。
 CO2(g) + H2(g),在830K温度下达到平衡。
CO2(g) + H2(g),在830K温度下达到平衡。①830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,则该反应的平衡常数K=
②830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为
(2)已知反应:2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ;则CO的燃烧热为
(3)已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92kJ/mol。取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量
2NH3(g) ΔH=-92kJ/mol。取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量
您最近一年使用:0次
2017-11-17更新
|
234次组卷
|
2卷引用:河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题
10-11高二上·福建·阶段练习
9 . 已知2SO2(g)+ O2(g) 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
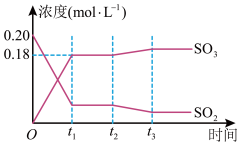
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为___________ mol·L-1·min-1。计算500℃时该反应的平衡常数K=___________ 。
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:图中时刻t2发生改变的条件可能是___________ (写一个即可)。
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程___________ 。(不必求出x)
(4)某温度时,该反应的平衡常数K=5000,则该温度____ 500℃(填“>”、“<”、“=”)。
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y=______ mol。刚开始时反应向_______ (填“正”或“逆”)反应方向进行。
 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:图中时刻t2发生改变的条件可能是
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程
(4)某温度时,该反应的平衡常数K=5000,则该温度
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、ymol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y=
您最近一年使用:0次
11-12高二上·全国·期中
10 . 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________ ;
(2)该反应为______ 反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______ ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是__________ 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是
您最近一年使用:0次



