名校
1 . 在一定温度下,在某4L恒容容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。

(1)该反应的化学方程式为_________ (需要标注M、N的物质状态,且系数化成最简整数)。
(2)比较t2时刻,正、逆反应速率大小:v(正)_________ v(逆)(填“>”“=”或“<”)。
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)_________ mol·L-1·min-1。
(4)该反应的化学平衡常数K=_________ 。
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H_________ 0(填“>”“=”或“<”)。

(1)该反应的化学方程式为
(2)比较t2时刻,正、逆反应速率大小:v(正)
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)
(4)该反应的化学平衡常数K=
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H
您最近一年使用:0次
2 . T℃时,在恒容密闭容器中通入 ,发生反应
,发生反应 测得容器内初始压强为40kPa,反应过程中反应速率
测得容器内初始压强为40kPa,反应过程中反应速率 、时间(t)与
、时间(t)与 分压
分压 的关系如图所示。
的关系如图所示。

(1) 时,
时, 的转化率
的转化率
_______ %
(2)反应速率满足 ,
,
_______ 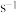 ,
,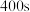 时
时
_______ 
(3)达到平衡时,测得体系的总压强 ,则该反应的平衡常数
,则该反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 ,发生反应
,发生反应 测得容器内初始压强为40kPa,反应过程中反应速率
测得容器内初始压强为40kPa,反应过程中反应速率 、时间(t)与
、时间(t)与 分压
分压 的关系如图所示。
的关系如图所示。
(1)
 时,
时, 的转化率
的转化率
(2)反应速率满足
 ,
,
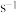 ,
,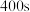 时
时

(3)达到平衡时,测得体系的总压强
 ,则该反应的平衡常数
,则该反应的平衡常数
您最近一年使用:0次
名校
解题方法
3 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: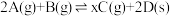 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
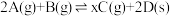 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题
江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
4 . 完成下列问题。
(1)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) △H<0,反应达到平衡时CH3OH(g)的体积分数(φ)与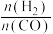 的关系如下图所示。
的关系如下图所示。
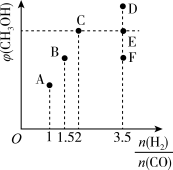
①当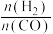 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=_______ (保留一位小数)。
②当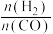 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的_____ (填“D”“E”或“F”)点。
(2)另一科研小组控制起始时容器中只有amol/LCO和bmol/LH2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

③若恒温(T1)恒容条件下,起始时 ,测得平衡时混合气体的压强为
,测得平衡时混合气体的压强为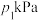 ,则
,则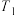 时该反应的压强平衡常数
时该反应的压强平衡常数 =
=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含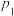 的代数式表示)。
的代数式表示)。
④若在温度为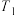 、压强为
、压强为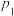 的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时
的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时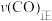
_______  (填“>”、“<”、“=”或“无法确定”)。
(填“>”、“<”、“=”或“无法确定”)。
(1)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g) △H<0,反应达到平衡时CH3OH(g)的体积分数(φ)与
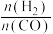 的关系如下图所示。
的关系如下图所示。
①当
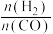 =2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=
=2时,经过5min达到平衡,CO的转化率为0.6,则该反应的化学平衡常数K=②当
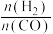 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的(2)另一科研小组控制起始时容器中只有amol/LCO和bmol/LH2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

③若恒温(T1)恒容条件下,起始时
 ,测得平衡时混合气体的压强为
,测得平衡时混合气体的压强为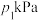 ,则
,则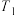 时该反应的压强平衡常数
时该反应的压强平衡常数 =
=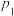 的代数式表示)。
的代数式表示)。④若在温度为
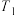 、压强为
、压强为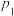 的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时
的条件下向密闭容器中加入CO、H2、CH3OH气体的物质的量之比为2∶1∶2,则反应开始时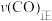
 (填“>”、“<”、“=”或“无法确定”)。
(填“>”、“<”、“=”或“无法确定”)。
您最近一年使用:0次
解题方法
5 . 250℃和100kPa下密闭容器中发生反应:PCl5(g) PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
(1)PCl5的分压是___ kPa。(保留三位有效数字)
(2)250℃时用分压表达的平衡常数Kp=___ kPa。(保留三位有效数字)
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是___ ,理由是___ 。
 PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。
PCl3(g)+Cl2(g),分解率为80.0%。已知分压是其体积分数乘总压。(1)PCl5的分压是
(2)250℃时用分压表达的平衡常数Kp=
(3)250℃和100kPa下密闭容器中含有0.1molPCl5,0.5molPCl3和0.2molCl2,反应进行的方向是
您最近一年使用:0次
名校
解题方法
6 . 2SO2(g)+O2(g) 2SO3(g)ΔH<0是制备硫酸的重要反应。将4molSO2与2molO2放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时SO3的浓度为1.5mol/L。
2SO3(g)ΔH<0是制备硫酸的重要反应。将4molSO2与2molO2放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时SO3的浓度为1.5mol/L。
(1)用O2表示的平均速率为___ ,平衡时SO2的转化率为___ 。
(2)写出该反应的化学平衡常数表达式K=___ ;如温度升高时,K值将___ (选填“增大”“减小”或“不变”)。
(3)若不改变反应温度和反应物中SO2的起始浓度,使SO2的平衡转化率达到90%,则O2的起始物质的量浓度为___ mol/L。
 2SO3(g)ΔH<0是制备硫酸的重要反应。将4molSO2与2molO2放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时SO3的浓度为1.5mol/L。
2SO3(g)ΔH<0是制备硫酸的重要反应。将4molSO2与2molO2放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时SO3的浓度为1.5mol/L。(1)用O2表示的平均速率为
(2)写出该反应的化学平衡常数表达式K=
(3)若不改变反应温度和反应物中SO2的起始浓度,使SO2的平衡转化率达到90%,则O2的起始物质的量浓度为
您最近一年使用:0次
解题方法
7 . 对于可逆反应CO+H2O(g)⇌CO2+H2,回答下列问题:
(1)830 K时,若起始时c(CO)=2 mol•L﹣1,c(H2O)=3 mol•L﹣1,平衡时CO的转化率为60%,水蒸气的转化率为_____ ;平衡常数K的值为_____ 。
(2)830 K时,若只将起始时c(H2O)改为6 mol•L﹣1,则水蒸气的转化率为_____ 。
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol•L﹣1、c(CO)=0.6 mol•L﹣1、c(H2O)=3 mol•L﹣1,c(H2)=2 mol•L﹣1请判定该体系中反应进行的方向:_____ (填“正向进行”“逆向进行”或“达到平衡”)。
(1)830 K时,若起始时c(CO)=2 mol•L﹣1,c(H2O)=3 mol•L﹣1,平衡时CO的转化率为60%,水蒸气的转化率为
(2)830 K时,若只将起始时c(H2O)改为6 mol•L﹣1,则水蒸气的转化率为
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol•L﹣1、c(CO)=0.6 mol•L﹣1、c(H2O)=3 mol•L﹣1,c(H2)=2 mol•L﹣1请判定该体系中反应进行的方向:
您最近一年使用:0次
2019-12-31更新
|
212次组卷
|
2卷引用:江西省南昌市五校2019-2020学年高二11月月考化学试题
名校
8 . 某温度,将2molCO与5 mol H2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
(1)0~5min内,v(CH3OH)=____
(2)若保持体积不变,再充入2molCO和1.5molCH3OH,此时v(正)__ v(逆)(填“>”“<”或“=”),平衡常数为____ 。
(3)在题干其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,H2的体积分数与原平衡对比:____ 。
(4)已知CO与H2在一定条件下也能合成乙醇,0.5mol乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1kJ/mol,又知H2O(l)═H2O(g);△H=+44.2kJ/mol,请写出乙醇燃烧热的热化学方程式____ 。
 CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。(1)0~5min内,v(CH3OH)=
(2)若保持体积不变,再充入2molCO和1.5molCH3OH,此时v(正)
(3)在题干其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,H2的体积分数与原平衡对比:
(4)已知CO与H2在一定条件下也能合成乙醇,0.5mol乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1kJ/mol,又知H2O(l)═H2O(g);△H=+44.2kJ/mol,请写出乙醇燃烧热的热化学方程式
您最近一年使用:0次
名校
9 . 某温度下,将H2(g)和I2(g)各0.9 mol的气态混合物充入2 L的密闭容器中,充分反应,5 min后达到平衡,测得c(HI)=0.3 mol/L。(写出计算过程)
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率________________ 。
(2)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2 mol,求达到平衡时I2(g)的物质的量浓度___________________ 。
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率
(2)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2 mol,求达到平衡时I2(g)的物质的量浓度
您最近一年使用:0次
解题方法
10 . 恒温、恒压下,在一个容积可变的容器中发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为________ mol
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入H2的物质的量为________ mol(平衡时NH3的质量分数与(1)中相同)。
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则y=________ 。平衡时H2的物质的量________ (选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为________ 。
 2NH3(g)
2NH3(g) (1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入H2的物质的量为
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则y=
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为
您最近一年使用:0次
2017-10-27更新
|
244次组卷
|
4卷引用:江西省宜春市上高二中2017-2018学年高二第一次月考化学试题



