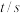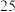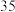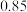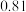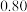1 . t ℃时,将2mol A 和 6 mol B 充入容积固定为 2 L 的密闭容器中发生反应: A(g)+2B(g)  2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
(1)第 2 min 到第 4 min 内 A 的平均反应速率为_______
(2)t ℃时该反应的平衡常数为_______
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=_______ 。(写出三个题 完整计算过程,无计算过程不给分)
 2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:
2C(g)。 反应 2 min 时测得 C 的浓度为 0.4 mol·L- 1 ,4 min 末反应达到平衡, B 的转化率为 50%。试计算:(1)第 2 min 到第 4 min 内 A 的平均反应速率为
(2)t ℃时该反应的平衡常数为
(3)若从反应开始到建立平衡时放出热量 353.88 kJ,则该反应的 ΔH=
您最近一年使用:0次
2 . 甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______ 。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______ 。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正_____ v逆(填“>”“=”或“<”)。
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为_______ 。
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______ ,乙中CO2的转化率_______ (填“大于”、“等于”或“小于”)甲。
| 化学反应 | 平衡常数 | 温度/ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为
| 起始浓度 | 甲 | 乙 |
| c(H2)/mol/L | 0.10 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.20 |
您最近一年使用:0次
3 . 一定温度下,向 恒容容器中充入
恒容容器中充入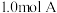 和
和 ,发生反应
,发生反应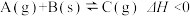 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
(1)前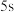 的平均反应速率
的平均反应速率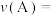
_______ ,达平衡时 的平衡体积分数为
的平衡体积分数为_______ 。
(2)由表中数据计算该温度下该反应的平衡常数为_______ ,随着反应温度升高,该反应的平衡常数_______ (选填“增大”、“减小”或“不变”)。
(3)保持温度不变,起始时向容器中充入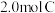 ,达平衡时,
,达平衡时, 的转化率为
的转化率为_______ 。
 恒容容器中充入
恒容容器中充入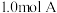 和
和 ,发生反应
,发生反应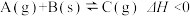 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
|
|
|
|
|
|
 |
|
|
|
|
|
(1)前
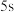 的平均反应速率
的平均反应速率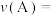
 的平衡体积分数为
的平衡体积分数为(2)由表中数据计算该温度下该反应的平衡常数为
(3)保持温度不变,起始时向容器中充入
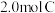 ,达平衡时,
,达平衡时, 的转化率为
的转化率为
您最近一年使用:0次
2021-02-03更新
|
212次组卷
|
2卷引用:四川省乐山市2020-2021学年高二上学期期末考试化学试题
名校
4 . 已知N2O4(g) 2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)20s时,N2O4的分解率是___ 。
(2)40s时,NO2的浓度为___ ,0~40s内N2O4的平均反应速率为____ 。
(3)在80℃时该反应的平衡常数K值为___ 。
(4)判断t2、t3、t4时刻对该反应采取的措施。
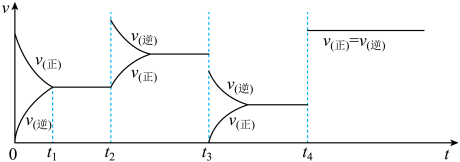
t2:___ ;t3:___ ;t4:___ 。
 2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.12 | c | d | e |
| c(NO2) | 0.00 | 0.08 | b | 0.20 | 0.20 | 0.20 |
(1)20s时,N2O4的分解率是
(2)40s时,NO2的浓度为
(3)在80℃时该反应的平衡常数K值为
(4)判断t2、t3、t4时刻对该反应采取的措施。

t2:
您最近一年使用:0次
5 . 在一个2L的密闭容器中,将2molCO和8molH2O混合加热至800℃,达到如下平衡:CO(g)+H2O(g) ⇌CO2(g)+H2(g)△H=+550kJ·mol-1K=1.0(请写出计算过程)
(1)求H2O的平衡转化率___ 。
(2)达到平衡时吸收的热量为多少?___ 。
(3)达到平衡后,保持温度体积不变,再充入1molCO和1molCO2平衡向哪个方向移动?___
(1)求H2O的平衡转化率
(2)达到平衡时吸收的热量为多少?
(3)达到平衡后,保持温度体积不变,再充入1molCO和1molCO2平衡向哪个方向移动?
您最近一年使用:0次
6 . 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)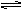 C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)该温度下,该反应的化学平衡常数K=________________ 。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________ ,通过计算说明此时,该反应是否达到了平衡状态__________ ?
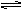 C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是
您最近一年使用:0次
解题方法
7 . 一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g) PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
请回答下列问题:
(1)x的值是___ 。
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是__ 。
(3)60s时,PCl5的转化率是__ 。
(4)达平衡时,容器中Cl2的体积分数是__ (结果保留一位小数),由表中数据计算此条件下,该反应的平衡常数是__ mol·L-1。
 PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);| t/s | 0 | 60 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
请回答下列问题:
(1)x的值是
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是
(3)60s时,PCl5的转化率是
(4)达平衡时,容器中Cl2的体积分数是
您最近一年使用:0次
解题方法
8 . 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4 (g) 2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___ 0(填“﹥”或“﹤”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___________ mol·L-1·s-1,反应的平衡常数K为_______ mol·L-1。

(2)100℃时,在容积为1.00L的容器中,通入1mol NO2(g)和1mol N2O4(g),此时v正_______ v逆(填“>”或“<”或“=”)。
 2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:
2NO2 (g)△H,随温度升高,混合气体的颜色变深。回答下列问题:(1)反应的△H

(2)100℃时,在容积为1.00L的容器中,通入1mol NO2(g)和1mol N2O4(g),此时v正
您最近一年使用:0次
解题方法
9 . 一定温度下,在三个体积均为V L的恒容密闭容器中发生反应:2SiHCl3(g) SiH2Cl2(g)+ SiCl4(g)
SiH2Cl2(g)+ SiCl4(g)
则:
(1)该反应的正反应为_________ (选填“放热”或“吸热”)反应。
(2)表中a =________ 。
(3)在保持容器Ⅲ的实验条件下,若起始时充入0.40mol SiHCl3(g)、0.40 mol SiH2Cl2(g)、0.20mol SiCl4(g),则达平衡时容器中SiHCl3的物质的量为_________ (请写出解题过程)
 SiH2Cl2(g)+ SiCl4(g)
SiH2Cl2(g)+ SiCl4(g)| 容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||
| SiHCl3(g) | SiH2Cl2(g) | SiCl4(g) | SiHCl3(g) | ||
| Ⅰ | T1 | 1.0 | 0 | 0 | 0.80 |
| Ⅱ | T1 | 0.40 | a | a | 0.36 |
| Ⅲ | T2 (T2>T1) | 0.20 | 0 | 0 | 0.10 |
则:
(1)该反应的正反应为
(2)表中a =

(3)在保持容器Ⅲ的实验条件下,若起始时充入0.40mol SiHCl3(g)、0.40 mol SiH2Cl2(g)、0.20mol SiCl4(g),则达平衡时容器中SiHCl3的物质的量为
您最近一年使用:0次
名校
10 . 按要求回答下列问题:
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)⇌CH3OH(g);△H1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是______ (填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
由表中数据判断△H1______ 0,T℃时,将2mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为______ 。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______ 。
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)⇌CH3OH(g);△H1
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
您最近一年使用:0次