名校
1 . CH3OH是一种重要的化工原料,广泛应用于化工生产,根据所学回答下列问题:
(1)工业上制备甲醇的反应方程式为: ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
①写出该反应体系中CO2的电子式___________ 。
②用H2表示前2h的平均反应速率v(H2)=___________ 。
③该温度下,CO2的平衡转化率为___________ 。
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C. D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键
⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为
___________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)CH3OH制备丙烯的反应为: ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: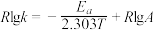 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。

①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能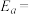
___________ 
②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是___________ (填标号)
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(1)工业上制备甲醇的反应方程式为:
 ,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
,某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:| 时间/h | l | 2 | 3 | 4 | 5 | 6 |
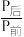 | 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
②用H2表示前2h的平均反应速率v(H2)=
③该温度下,CO2的平衡转化率为
④在一定条件下,下列说法能说明该可逆反应达到平衡状态的是
A.容器中气体密度不变 B.容器中气体平均摩尔质量不变
C.
 D.形成2molC=O键同时断裂3molH-H键
D.形成2molC=O键同时断裂3molH-H键⑤在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为

(2)CH3OH制备丙烯的反应为:
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为:
,速率常数k与反应温度T的关系遵循Arrhenius方程,已知Arrhenius方程为: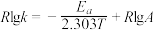 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能:
为活化能: ,A为常数)。
,A为常数)。
①在一定条件下,测得实验数据如上图曲线a所示。则该条件下,反应的活化能
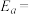

②若实验时改变外界条件,测得实验数据为如上图曲线b所示,则可能改变的外界条件是
A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂
您最近一年使用:0次
2023-06-30更新
|
432次组卷
|
2卷引用:山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷
名校
解题方法
2 . 氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量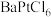 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
___________ kPa,反应 的平衡常数K=
的平衡常数K=___________ (保留两位有效数字)。
 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量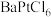 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题
(1)在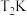 、
、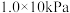 下,等物质的量的CO与
下,等物质的量的CO与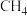 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,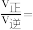
_______ 。
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,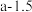 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K=_______  。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将_______ , 的体积分数将
的体积分数将_______ (填“增大”“减小”或“不变”)。

(3)反应 的反应机理如下:
的反应机理如下:
①第一步: (快速平衡)
(快速平衡)
第二步: (快速平衡)
(快速平衡)
第三步: (慢反应)
(慢反应)
②只需一步完成的反应称为基元反应,基元反应如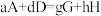 的速率方程,
的速率方程,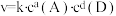 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成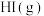 的速率方程为v=
的速率方程为v=_______  (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。
(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 的,催化氧化:
的,催化氧化:
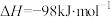 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%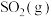 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(1)在
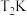 、
、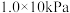 下,等物质的量的CO与
下,等物质的量的CO与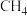 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,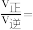
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,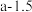 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K= 。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将 的体积分数将
的体积分数将
(3)反应
 的反应机理如下:
的反应机理如下:①第一步:
 (快速平衡)
(快速平衡)第二步:
 (快速平衡)
(快速平衡)第三步:
 (慢反应)
(慢反应)②只需一步完成的反应称为基元反应,基元反应如
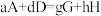 的速率方程,
的速率方程,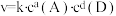 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成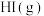 的速率方程为v=
的速率方程为v= (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是
 的,催化氧化:
的,催化氧化:
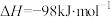 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%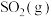 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
您最近一年使用:0次
4 . CO是生产羰基化学品的基本原料,850℃时,在恒容密闭容器中通入CO和 ,发生反应:
,发生反应: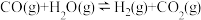
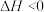 ,测定浓度随时间的关系如下表:
,测定浓度随时间的关系如下表:
回答下列问题。
(1)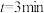 时,v(正)
时,v(正)___________ v(逆)(填“>”、“<”或“=”)。
(2)0~2min,CO的平均反应速率为___________ 。
(3)反应达到平衡时, 的转化率为
的转化率为___________ ;该温度下反应的平衡常数为___________ 。
(4)850℃时,在体积可变的密闭容器中,以下表中物质不同的起始浓度进行反应,达到平衡时CO的百分含量与原平衡相同的是___________ (填字母序号)。
 ,发生反应:
,发生反应: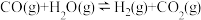
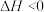 ,测定浓度随时间的关系如下表:
,测定浓度随时间的关系如下表: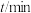 |  | 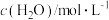 |
| 0 | 0.30 | 0.20 |
| 2 | 0.10 | |
| 3 | 0.18 | |
| 4 | 0.08 |
(1)
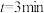 时,v(正)
时,v(正)(2)0~2min,CO的平均反应速率为
(3)反应达到平衡时,
 的转化率为
的转化率为(4)850℃时,在体积可变的密闭容器中,以下表中物质不同的起始浓度进行反应,达到平衡时CO的百分含量与原平衡相同的是
 | 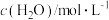 | 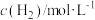 | 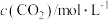 | |
| a | 2 | 1 | 1 | 1 |
| b | 0.6 | 0.4 | 0 | 0 |
| c | 0.2 | 0 | 0.1 | 0.1 |
| d | 1 | 1 | 1 | 1 |
您最近一年使用:0次
解题方法
5 . 工业合成氨反应为:N2(g)+3H2(g) 2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
计算:
(1)前10分钟内平均反应速率v(N2)=______ 。
(2)该温度下此反应的平衡常数K=_____ 。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol·L-1、3mol·L-1、3mol·L-1,通过计算判断此时v正和v逆相对大小____ 。
 2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
计算:
(1)前10分钟内平均反应速率v(N2)=
(2)该温度下此反应的平衡常数K=
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol·L-1、3mol·L-1、3mol·L-1,通过计算判断此时v正和v逆相对大小
您最近一年使用:0次
6 . 在一个2 L的恒容密闭容器中,加入3 molA和1 molB发生如下反应:3A(g) +B(g) 2C(g) +3D(?)。5 min后达到平衡,C的浓度为 0.6 mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g) +3D(?)。5 min后达到平衡,C的浓度为 0.6 mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是__________ 反应(填“吸热”或“放热”), D的状态是________ (填“气态”或“非气态”)。
(2)达到平衡时,A的转化率为________ ,此温度下的平衡常数K____ (保留两位小数)。
 2C(g) +3D(?)。5 min后达到平衡,C的浓度为 0.6 mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g) +3D(?)。5 min后达到平衡,C的浓度为 0.6 mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)达到平衡时,A的转化率为
您最近一年使用:0次
7 . 在80℃时,将0.4 mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)表中b________ c(填“<”、“=”或“>”)。
(2)0-20s内N2O4的平均反应速率为__________ 。
(3)在80℃时该反应的平衡常数K的数值为__________ 。
(4)CO2可以被NaOH溶液吸收,若所得溶液c( )∶c(
)∶c( )=2∶1,溶液pH=
)=2∶1,溶液pH=______ 。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(5)25 ℃时,H2SO3 H++
H++ 的电离平衡常数为Ka,已知该温度下NaHSO3的水解平衡常数Kh=1×10-12。则Ka=
的电离平衡常数为Ka,已知该温度下NaHSO3的水解平衡常数Kh=1×10-12。则Ka=_______ 。
时间/(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(mol/L) | 0.20 | a | 0.10 | c | d | e |
c(NO2)/(mol/L) | 0.00 | 0.12 | b | 0.22 | 0.24 | 0.24 |
(2)0-20s内N2O4的平均反应速率为
(3)在80℃时该反应的平衡常数K的数值为
(4)CO2可以被NaOH溶液吸收,若所得溶液c(
 )∶c(
)∶c( )=2∶1,溶液pH=
)=2∶1,溶液pH=(5)25 ℃时,H2SO3
 H++
H++ 的电离平衡常数为Ka,已知该温度下NaHSO3的水解平衡常数Kh=1×10-12。则Ka=
的电离平衡常数为Ka,已知该温度下NaHSO3的水解平衡常数Kh=1×10-12。则Ka=
您最近一年使用:0次
名校
解题方法
8 . 煤化工中常需研究不同温度下的平衡常数、产率及不同投料比对反应方向的影响等问题。已知反应CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
试回答下列问题。
(1)该反应的化学平衡常数表达式为K=________ 。
(2)在相同条件下,为增大反应物的转化率,该反应应在________ (填“高温”或“低温”)条件下进行。
(3)在830 ℃时发生上述反应,按下表中的物质的量将各物质投入恒容反应器中,其中向正反应方向进行的反应有________ (填序号)。
 H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
H2(g)+CO2(g)的平衡常数随温度的变化如表所示:温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题。
(1)该反应的化学平衡常数表达式为K=
(2)在相同条件下,为增大反应物的转化率,该反应应在
(3)在830 ℃时发生上述反应,按下表中的物质的量将各物质投入恒容反应器中,其中向正反应方向进行的反应有
选项 | A | B | C | D |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5 | 2 | 3 | 2 |
您最近一年使用:0次
2020-09-18更新
|
185次组卷
|
2卷引用:山东省枣庄市第八中学(东校区)2020-2021学年高二上学期9月月考化学试题
名校
解题方法
9 . T℃ 时,在一容积为 2 L 的恒容密闭容器中加入 2 mol A 和 3 mol B,压强为 P0, 在催化剂存在的条件下进行下列反应:2A(g)+3B(g) ⇌3C(g),2 分钟达到平衡,平衡混合气中 C 的体积分数为 37.5%。 已知该反应某一时刻的瞬时速率计算公式为v正=k正·[A]2·[B]3,v逆=k逆·[C]3,其中 k正、k逆为速率常数。
(1)计算上述条件下 的值。 (写出必要的计算过程,下同)
的值。 (写出必要的计算过程,下同)_____
(2)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数,记作 Kp。已知某气体分压(P分)=气体总压(P总) ×该气体的物质的量分数,计算 T℃ 时上述反应 Kp 的值(用含 P0 的数值表示)。____________
(1)计算上述条件下
 的值。 (写出必要的计算过程,下同)
的值。 (写出必要的计算过程,下同)(2)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数,记作 Kp。已知某气体分压(P分)=气体总压(P总) ×该气体的物质的量分数,计算 T℃ 时上述反应 Kp 的值(用含 P0 的数值表示)。
您最近一年使用:0次
2020-03-27更新
|
348次组卷
|
3卷引用:山东省泰安市2019-2020学年高二上学期期末考试化学试题
名校
10 . (1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________ 。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知反应N2+3H2 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________ 。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________ MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2
 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g)
 CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=
您最近一年使用:0次
2019-11-03更新
|
129次组卷
|
2卷引用:山东省日照市第一中学2019-2020学年高二10月月考化学试题



